
分析 (1)除去Fe2+时,应避免Cu2+生成沉淀;
①NaClO为强碱弱酸盐,水解呈碱性;
②加入氧化剂时,不能引入新的杂质;
③加入氧化剂时,必须既能除去新杂质又不能引入新的杂质;
(2)使Fe3+转化为Fe(OH)3沉淀,应调节溶液的pH,所加物质能与酸反应,注意不能引入新杂质.
解答 解:(1)由题给信息可知,除去Fe2+时,应避免Cu2+生成沉淀,如直接调整溶液pH=9.6,则生成氢氧化亚铁的同时,氢氧化铜、氢氧化铁也同时生成,
故答案为:不能;因Fe2+沉淀的pH最大,Fe2+沉淀完全时,Cu2+、Fe3+也会沉淀完全;
①NaClO为强碱弱酸盐,水解呈碱性,则加入NaClO,溶液的pH一定增大,另外NaClO可以酸反应生成HClO而导致溶液pH增大,故答案为:A;
②加入氧化剂时,不能引入新的杂质,如用NaClO,则可引入NaCl杂质,故答案为:否;引入了新杂质Na+;
③加入氧化剂时,必须既能除去新杂质又不能引入新的杂质.
A.浓HNO3能引入NO3-,故A错误;
B、KMnO4被还原为Mn2+,故引入了新杂质,故B错误;
C、Cl2能氧化Fe2+且引入的Cl-不是杂质,故C正确;
D.O2能氧化Fe2+且不引入杂质,故D正确;
故选CD;
(2)使Fe3+转化为Fe(OH)3沉淀,应调节溶液的pH,所加物质能与酸反应,注意不能引入新杂质,则可用CuO 或Cu(OH)2或CuCO3或Cu2(OH)2CO3 .
故答案为:C.
点评 本题考查较为综合,涉及物质的分离、提纯和制备,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及题给信息,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 大小烧杯间填满碎纸片 | B. | 大烧杯上用硬纸板作盖板 | ||
| C. | 使用环形玻璃搅拌棒 | D. | 分别使用两个量筒量取酸液和碱液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
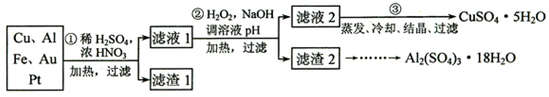
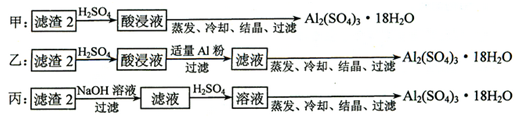
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层.
(1)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 反应温度/℃ | 反应时间(min) | 收率 |
| 30~35 | 180 | 10.0 |
| 20~25 | 60 | 18.0 |
| 20~25 | 120 | 26.0 |
| 20~25 | 180 | 58.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加N2的量,可以加快反应速率 | |
| B. | 当N2和H2全部转化为NH3时,反应才达到最大限度 | |
| C. | 达到平衡时,H2和NH3的浓度比一定为3:2 | |
| D. | 分别用N2和NH3来表示该反应的速率时,数值大小相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
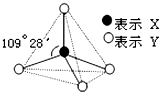 甲、乙、丙、丁、戊具有如图所示的结构或结构单元,图中四面体外可能有的部分未画出,只有实线表示共价键,X、Y可同可不同.
甲、乙、丙、丁、戊具有如图所示的结构或结构单元,图中四面体外可能有的部分未画出,只有实线表示共价键,X、Y可同可不同.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com