
| A. | 如果电子云图象是由两个s电子重叠形成的,即形成s-sσ键 | |
| B. | s电子与p电子形成s-pσ键 | |
| C. | p电子和p电子不能形成σ键 | |
| D. | HCl分子里含有一个s-pσ键 |
科目:高中化学 来源: 题型:解答题
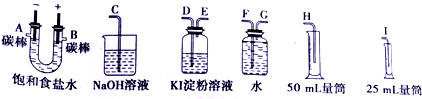
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molMg2+含有NA个电子 | |
| B. | 1mol•L-1的NaCl溶液中含有NA个Na+ | |
| C. | 2molCu与足量S加热充分反应,转移2NA个电子 | |
| D. | 4gCH4与Cl2在光照条件下反应全部转化为CCl4时,断裂NA个C-H键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
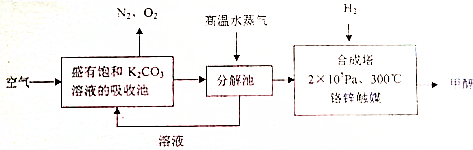
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层有2个电子的元素都是金属元素 | |
| B. | 不管哪一个电子层作为最外层,其电子数都不能超过8个 | |
| C. | 在原子核外的电子层中,电子层大的能量低,电子层小的能量高 | |
| D. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
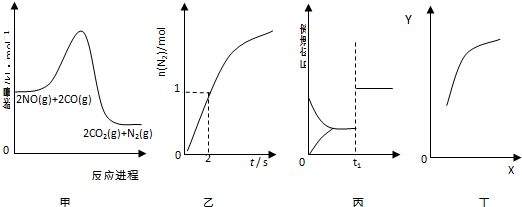
| A. | 由图象甲可知,该反应正反应为放热反应 | |
| B. | 由图象乙可知,0~2s内平均速率V(CO)=1mol•L-1•s-1 | |
| C. | 由图象丙可知,t1时改变的条件可能为增大压强 | |
| D. | 由图象丁中,若X为c(CO),则纵坐标Y可能为NO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠和铁的熔化 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 碘和干冰的升华 | D. | 食盐和冰的熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
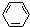 、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com