
C
解析:本题有两种解法。
方法1(推断法)CH4与Cl2的取代反应逐步进行,通常得到的是多种取代物的混合物,即下列反应几乎同时发生:
CH4+ Cl2![]() CH3Cl + HCl
CH3Cl + HCl
CH3Cl+ Cl2![]() CH2Cl2+ HCl
CH2Cl2+ HCl
CH2Cl2+ Cl2![]() CHCl3+ HCl
CHCl3+ HCl
CHCl3+ Cl2![]() CCl4+ HCl
CCl4+ HCl
有机产物为CH3Cl、CH2Cl2、CHCl3、CCl4,因4种有机产物的物质的量相等,而CH4的物质的量为1 mol,则这4种取代物应各为0.25 mol,消耗Cl2的物质的量为:0.25 mol×1+0.25 mol×2+0.25 mol×3+0.25 mol×4=2.5 mol。
方法2(写总反应方程式法)由题意:
4CH4+(1+2+3+4)Cl2![]() CH3Cl + CH2Cl2+CHCl3+CCl4+ 10HCl
CH3Cl + CH2Cl2+CHCl3+CCl4+ 10HCl
4 10
1 mol n(Cl2)
n(Cl2)=2.5 mol


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
A.若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收
B.产物的平均摩尔质量为
C.若将产物通过浓硫酸充分吸收后恢复至101 kPa、
D.反应中消耗的氧气为
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省高三3月摸底考试理综化学试卷(解析版) 题型:填空题
甲醇燃料分为甲醇汽油和甲醇柴油。工业上合成甲醇的方法很多。
(1)一定条件下发生反应:
CO2(g) +3H2(g) =CH3OH(g)+H2O(g)? △H1
2CO (g) +O2(g) =2CO2(g)?? △H2
2H2(g)+O2(g) =2H2O(g)??? △H3
则 CO(g) + 2H2(g)  CH3OH(g) 的△H=??????????????? 。
CH3OH(g) 的△H=??????????????? 。
(2)在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH) 与反应时间t的变化曲线如图所示。该反应的△H???? 0 (填>、<或=)。
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH) 与反应时间t的变化曲线如图所示。该反应的△H???? 0 (填>、<或=)。

(3)若要提高甲醇的产率,可采取的措施有____________(填字母)。
A.缩小容器体积
B.降低温度
C.升高温度
D.使用合适的催化剂
E.将甲醇从混合体系中分离出来
(4)CH4和H2O在催化剂表面发生反应CH4+H2O CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数????? (结果保留小数点后两位数字)。
CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数????? (结果保留小数点后两位数字)。
(5)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的 传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
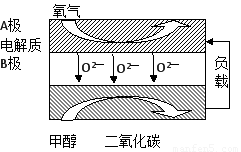
①B极的电极反应式为????????????????????? 。
②若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当电路中转移1mole- 时,实际上消耗的甲醇的质量比理论上大,可能原因是????????????????????? 。
(6)25℃时,草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。向20ml碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol·L-1的草酸钾溶液20ml,能否产生沉淀?????? (填“能”或“否”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省吉安市高三上学期期末教学质量评价化学试卷(解析版) 题型:填空题
开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)甲烷水蒸气转化法制H2的主要转化反应如下:
CH4(g) + H2O(g) CO(g) + 3H2(g)? △H=+206.2 kJ·mol-1
CO(g) + 3H2(g)? △H=+206.2 kJ·mol-1
CH4(g) + 2H2O(g) CO2(g) + 4H2(g)? △H=+165.0 kJ·mol-1
CO2(g) + 4H2(g)? △H=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使合成氨的催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是??????? 。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g)? ΔH>0
CO(g) + 3H2(g)? ΔH>0
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为___________。(填“<”、“>”、“=” );

②100℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是__________
a.容器内气体密度恒定??
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定??????
d.3v正(CH4) = v逆(H2)
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____。

A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(Na+)=0.1mol/L
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与水反应得到HF和化合物A,该反应的化学方程式为????????????????????? 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年北京市通州区高三年级上学期期末摸底考试化学试卷(解析版) 题型:填空题
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:① 2CH3OH(1) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 = – 1275.6 kJ/mol
② 2CO(g) + O2(g) = 2CO2(g) ΔH2 = – 566.0 kJ/mol
③ H2O(g) = H2O(1) ΔH3 = – 44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g)
+ 3H2(g) ΔH>0
CO(g)
+ 3H2(g) ΔH>0
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则Tl ________T2(填“<”、“>”、“=”,下同);A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为___________。

②100℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是__________
a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4) = v逆(H2)
如果达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K =___________
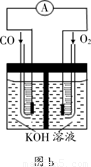
(3)某实验小组利用CO(g) 、 O2(g) 、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源:2013届湖北省高一下学期期中考试化学试卷 题型:选择题
将1 mol CH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101 kPa,120℃),其总质量为72 g,下列有关叙述不正确的是
A.若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收
B.产物的平均摩尔质量为24 g/mol
C.若将产物通过浓硫酸充分吸收,则压强变为原来的1/3
D.反应中消耗的氧气为56 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com