
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
科目:高中化学 来源: 题型:填空题
合理利用资源,降低碳的排放,实施低碳经济是今后经济生活主流方向。
⑴下列措施不利于有效减少二氧化碳排放的是 。
A.植树造林,保护森林,保护植被
B.加大对煤和石油的开采,并鼓励使用石油液化气
C.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高
D.倡导出行时多步行和骑自行车,建设现代物流信息系统,减少运输工具空驶率
⑵科学家致力于二氧化碳的“组合转化”技术研究,如将CO2和H2以1∶4比例混合通入反应器,适当条件下反应可获得一种能源。完成以下化学方程式:CO2+4H2 +2H2O。
+2H2O。
⑶CO2合成生产燃料甲醇(CH3OH)是碳减排的新方向。进行如下实验:某温度下在1 L的密闭容器中,充2 mol CO2和6 mol H2,发生:CO2(g)+3H2(g ) CH3OH(g)+H2O(g)能判断该反应已达化学反应限度标志的是 (填字母)。
CH3OH(g)+H2O(g)能判断该反应已达化学反应限度标志的是 (填字母)。
A.CO2百分含量保持不变
B.容器中H2浓度与CO2浓度之比为3:1
C.容器中混合气体的质量保持不变
D.CO2生成速率与CH3OH生成速率相等
现测得CO2和CH3OH(g)的浓度随时间变化如左下图所示。从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)。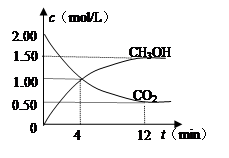
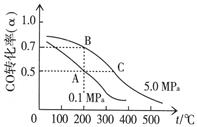
⑷CO在催化作用下也能生成甲醇:CO(g)+2H2(g)  CH3OH(g);已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如右上图所示。
CH3OH(g);已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如右上图所示。
①若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
②若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为VAL,则A、B两点时容器中,n(A)总︰n(B)总= 。
⑸以KOH为电解质的甲醇燃料电池总反应为:2CH3OH+3O2+4KOH= 2K2CO3+6H2O,通入甲醇的电极为燃料电池的负极,正极发生的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。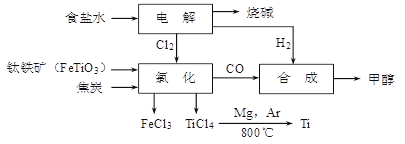
请回答下列问题:
(1)Ti的原子序数为22,Ti位于元素周期表中第_______周期,第______族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因: 。
(4)由TiCl4→Ti 需要在Ar气中进行的理由是_________________________________。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
 (5)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。
(5)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知下列两个反应:
反应Ⅰ:CO2(g)+H2(g)  CO(g)+H2O ΔH1
CO(g)+H2O ΔH1
反应Ⅱ:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH2
CO2(g)+H2(g) ΔH2
(1)相同温度下,若上述反应Ⅰ的化学平衡常数为K1,反应Ⅱ的化学平衡常数为K2,那么K1·K2=________。
(2)反应Ⅰ化学平衡常数K1和温度t的关系如下表一:
| t/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K1 | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 起始浓度 | 甲 | 乙 | 丙 |
| c(CO2)(mol/L) | 0.01 | 0.02 | 0.02 |
| c(H2)(mol/L) | 0.01 | 0.01 | 0.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
反应Ⅰ Ni(S)+4CO(g)
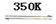 Ni(CO)4(g)△H1<0
Ni(CO)4(g)△H1<0
反应Ⅱ Ni(CO)4(g)  Ni(S)+4CO(g) △H2
Ni(S)+4CO(g) △H2
(1)在温度不变的情况下,要提高反应Ⅰ中Ni(CO)4的产率,可采取的措施有 、 。
(2)已知350K下的2L密闭容器中装有100g粗镍(纯度98.5%,所含杂质不与CO反应),通入6 molCO气体发生反应Ⅰ制备Ni(CO)4,容器内剩余固体质量和反应时间的关系如图所示,10min后剩余固体质量不再变化。
①反应Ⅰ在0~10min的平均反应速率v(Ni(CO)4)= 。
②若10min达到平衡时在右端得到29.5g纯镍,则反应Ⅰ的平衡常数K1为多少?(写出计算过程)
(3)反应Ⅱ中 △H2 0(填“>”、“<”、“=”);若反应Ⅱ达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 。(双选)
a.平衡常数K增大 b.CO的浓度减小 c.Ni的质量减小 d.v逆[Ni(CO)4]增大
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH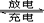 Ni(OH)2+M 电池充电时,阳极的电极反应式为 。电池充电时阴极上发生 (填“氧化”或“还原”)反应
Ni(OH)2+M 电池充电时,阳极的电极反应式为 。电池充电时阴极上发生 (填“氧化”或“还原”)反应
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2=H2SO4+2HI
Ⅱ.2HI H2↑+I2
H2↑+I2
Ⅲ.2H2SO4=2SO2+O2↑+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2的物质的量随时IP间的变化如图所示。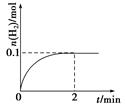
①0~2 min内的平均反应速率v(HI)= 。
②相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.HI的平衡浓度
b.达到平衡的时间
c.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,若加入少量下列固体试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在2 L密闭容器中进行反应:mX(g)+nY(g) pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
| 物质 时间 | X | Y | Z | Q |
| 起始/mol | 0.7 | | 1 | |
| 2 min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3 min末/mol | | | 0.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现将氢气和氮气充入某密闭容器中,在一定条件下反应的有关数据为:
| 项目 | H2 | N2 | NH3 |
| 起始时 | 5 mol·L-1 | 3 mol·L-1 | 0 |
| 2 s末 | 2 mol·L-1 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g)ΔH1
②IO-(aq)+H+(g)=HOI(aq)ΔH2
③HOI(aq)+I-(aq)+H+(aq)=I2(aq)+H2O(l)ΔH3
总反应的化学方程式为_________________________________,
其反应热ΔH=______________。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq)  I3-(aq),其平衡常数表达式为________。
I3-(aq),其平衡常数表达式为________。
(3)为探究Fe2+对O3氧化I-反应的影响(反应体系如图1),某研究小组测定两组实验中I3-浓度和体系pH,结果见图2和下表。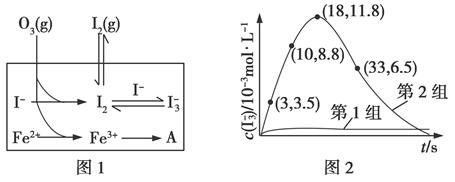
| 编号 | 反应物 | 反应前pH | 反应前pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com