
| A. | 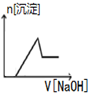 | B. | 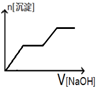 | C. | 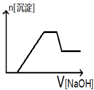 | D. | 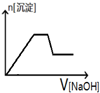 |
分析 加入NaOH溶液后,溶液中含有氢离子,在开始段没有生成沉淀,Fe3+、Al3+存在,加入氢氧化钠溶液有沉淀生成及部分沉淀溶解,中间段沉淀的质量不变,应为NH4++OH-=NH3•H2O的反应,根据离子反应发生的条件进行判断.
解答 解:某酸性溶液中含有Fe3+、Al3+、NH4+、Cl-,向其中逐渐加入稀NaOH溶液,开始反应为:H++OH-=H2O,随氢氧化钠溶液加入,反应生成沉淀的反应为:Al3++3OH-=Al(OH)3↓,Fe3++3OH-=Fe(OH)3↓,铵根离子交换氢氧根离子生成一水合氨,沉淀物质的量不变,随后加入氢氧化钠氢氧化铝溶解,最后沉淀物质的量不变,图象变化选择C,
故选C.
点评 本题考查了离子性质、离子反应的现象、离子反应顺序等知识点,题目难度中等.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:解答题

 x/m,该反应可用来检验Cr2O72-的存在.写出反应的离子方程式Cr2O72-+4H2O2+2H+=2CrO5+5H2O.
x/m,该反应可用来检验Cr2O72-的存在.写出反应的离子方程式Cr2O72-+4H2O2+2H+=2CrO5+5H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 异丙苯 | 120 | 0.8640 | 153 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 苯酚 | 94 | 1.0722 | 182 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雾霾有可能产生丁达尔现象 | |
| B. | “PM2.5”没有必要纳入空气质量评价指标 | |
| C. | 近年来雾霾的形成与工业排放的烟气有关系 | |
| D. | 研制开发燃料电池汽车,降低机动车尾气污染,某种程度上可以减少PM2.5污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙烷 | B. | 丙烯(C3H6) | C. | 丁炔(C4H6) | D. | 新戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠与氧气反应,条件不同,产物相同 | |
| B. | 金属钠着火可用冷水扑灭 | |
| C. | 少量的钠可保存在煤油中 | |
| D. | 钠的化学性质活泼,可从CuSO 4溶液中置换出Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com