
【题目】某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验:
Ⅰ.(1)将等质量的钾、钠、镁、铝分别投入到足量的同浓度的盐酸中,试预测实验结果:上述金属中 与盐酸反应最剧烈, 与盐酸反应生成的气体最多。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强。反应的离子方程式为 。
Ⅱ.利用下图装置来验证同主族元素非金属性的变化规律:
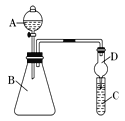
(1)要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液 的现象,即可证明。干燥管D的作用是 。从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用 溶液吸收尾气。
(2)要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,将观察到C中 的现象。但老师认为,该现象不足以证明酸性强弱关系为碳酸>硅酸,请用文字叙述理由 。因此应在B、D之间增加一个盛有足量 (选填下列字母:A.浓盐酸 B.浓NaOH溶液C.饱和Na2CO3溶液 D.饱和NaHCO3溶液)的洗气装置。改进后C中发生反应的化学方程式是 。
【答案】Ⅰ(1)钾(或K);铝(或Al);
(2)Cl2+S2-="=" S↓+2Cl-;
Ⅱ(1)变蓝;防止溶液倒吸;NaOH;
(2)有白色沉淀生成;从B中挥发出的HCl也会和硅酸钠溶液反应生成硅酸;D;
Na2SiO3+CO2+H2O ="=" H2SiO3↓+Na2CO3(或Na2SiO3+2CO2+2H2O ="=" H2SiO3↓+2NaHCO3);
【解析】试题分析:Ⅰ(1)金属活泼性顺序为:钾>钠>镁>铝,所以相同条件下与盐酸反应最激烈的是钾,反应速率最慢的是铝;生成1mol氢气需要得到2mol电子,1mol钾、钠都失去1mol电子,1mol镁失去2mol电子,而1mol铝失去3mol电子,所以生成氢气最多的是金属铝,故答案为:钾;铝;
(2)氯气氧化性强于硫单质,所以氯气能够与硫离子反应生成硫,反应的离子方程式为:S2-+Cl2═S↓+2Cl-,故答案为:S2-+Cl2═S↓+2Cl-;
Ⅱ(1)KMnO4与浓盐酸常温下反应生成氯气,氯气能够将碘离子氧化成碘单质,碘单质遇到淀粉变成蓝色,球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中,氯气是一种有毒气体,必须进行尾气吸收,氯气能够与氢氧化钠溶液反应,可以使用氢氧化钠溶液吸收多余的氯气,故答案为:变蓝;防止倒吸;NaOH;
(2)盐酸与碳酸钙反应生成二氧化碳,二氧化碳通入Na2SiO3溶液中,反应生成硅酸沉淀;氯化氢具有挥发性,干扰实验结果,需要将二氧化碳中的氯化氢除掉,根据氯化氢与碳酸氢钠反应,而二氧化碳不反应,可以在B和C之间增加装有饱和NaHCO3溶液的洗气瓶,反应的方程式为Na2SiO3+CO2+H2O ="=" H2SiO3↓+Na2CO3,故答案为:有白色沉淀生成;从B中挥发出的HCl也会和硅酸钠溶液反应生成硅酸;D;Na2SiO3+CO2+H2O ="=" H2SiO3↓+Na2CO3(或Na2SiO3+2CO2+2H2O ="=" H2SiO3↓+2NaHCO3)。


科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A.Na2O·SiO2是一种简单的硅酸盐,可溶于水
B.灰霾粒子平均直径在1 000~2 000 nm之间,能发生丁达尔效应
C.稀硫酸、NaCl溶液是实验室常见的电解质
D.酸性氧化物均能与水反应生成对应的酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是 ( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是 ( )
A.放电时负极反应为:Zn-2e+2OH =Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e+5OH =FeO42-+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A、CH2=CH﹣COOH和油酸(C17H33COOH)
B、12C60和石墨
C、![]() 和
和![]()
D、35Cl和37Cl
E、乙醇和乙二醇
(1)互为同位素的是 ;
(2)互为同系物的是 ;
(3)互为同素异形体的是 ;
(4)互为同分异构体的是 ;
(5)既不是同系物,又不是同分异体,也不是同素异形体,但可看成是同一类物质的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对热化学方程式C(s)+H2O(g)==CO(g)+H2(g) ΔH=+131.3 kJ·mol-1最准确的理解是( )
A.碳和水反应吸收131.3 kJ热量
B.1 mol碳和1 mol水反应生成一氧化碳和氢气,同时放出131.3 kJ热量
C.1 mol碳和1 mol水蒸气反应生成1 mol CO和1 mol H2,同时吸收131.3 kJ热量
D.1个固态碳原子和1分子水蒸气反应吸热131.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是( )
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中的曲线是反应2A(g)+B(g)![]() 2C(g) △H=QkJ/mol在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c、d四点,则下列描述正确的是
2C(g) △H=QkJ/mol在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c、d四点,则下列描述正确的是
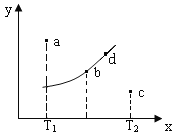
A.Q<0
B.平衡常数值:b点<d点
C.T1温度下若由a点达到平衡,可以采取增大压强的方法
D.c点v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() (R、R′、R″是各种烃基)如上式烯烃的氧化反应,双键被高锰酸钾酸性溶液氧化而断裂,在断键两端的碳原子都被氧化成为羧基或酮羰基.由氧化所得的产物,可以推测反应物烯烃的结构.今有A、B、C三个含有双键的化合物,它们被上述溶液氧化:
(R、R′、R″是各种烃基)如上式烯烃的氧化反应,双键被高锰酸钾酸性溶液氧化而断裂,在断键两端的碳原子都被氧化成为羧基或酮羰基.由氧化所得的产物,可以推测反应物烯烃的结构.今有A、B、C三个含有双键的化合物,它们被上述溶液氧化:
1molA(分子式C8H16),氧化得到2mol酮D.
1molB(分子式C8H14),氧化得到2mol酮E和1mol二元羧酸.
1molC(分子式C8H14),氧化只得到一种产物,它是一种没有支链的二元羧酸.
请据此推断B、C、D、E的结构简式为:B 、C 、D 、E .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com