
| 微粒 | ClO${\;}_{2}^{-}$ | ClO${\;}_{3}^{-}$ | ClO${\;}_{4}^{-}$ |
| 立体结构 | V形 | 三角锥形 | 正四面体 |
分析 根据价层电子对互斥理论来确定其空间构型,价层电子对个数=σ键个数+孤电子对个数=4,Cl是以sp3杂化轨道与O原子成键.
解答 解:ClO2-中价层电子对个数=2+$\frac{1}{2}$(7+1-2×2)=2,且含有2个孤电子对,所以是V型;
ClO3-中价层电子对个数=3+$\frac{1}{2}$(7+1-3×2)=4,且含有一个孤电子对,所以是三角锥形;
ClO4-中价层电子对个数=4+$\frac{1}{2}$(7+1-4×2)=4,且不含孤电子对,所以是正四面体型,
故答案为:
| 微粒 | ClO2- | ClO3- | ClO4- |
| 立体结构 | V形 | 三角锥形 | 正四面体 |
点评 本题考查了微粒的空间构型,根据价层电子对互斥理论确定其空间构型,注意孤电子对的确定方法,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 13.4 mL | B. | 22.40 mL | C. | 6.72 mL | D. | 0 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
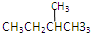 和
和
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
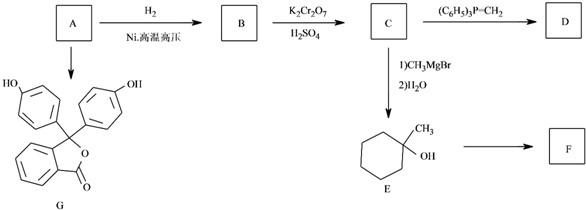
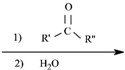
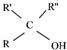
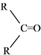 $\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$
$\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$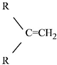 (R表示烃基,R′和R″表示烃基或基)
(R表示烃基,R′和R″表示烃基或基) .
. 、
、 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
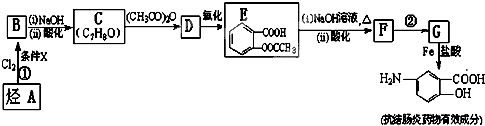
 .
. .
.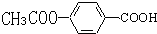
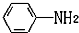 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物 的合成路线
的合成路线 .(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
.(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
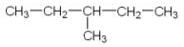
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com