
下列实验事实不能用平衡移动原理解释的是( )
A.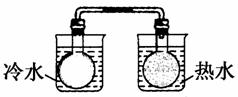
将NO2球浸泡在冷水和热水中
B.
| t/℃ | 25 | 50 | 100 |
| KW/10-14 | 1.01 | 5.47 | 55.0 |
C.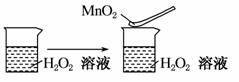
D.
| c(氨水)/(mol·L-1) | 0.1 | 0.01 |
| pH | 11.1 | 10.6 |
科目:高中化学 来源: 题型:
粗铜精炼后的阳极泥含有Cu、Au(金)和
PbSO4等杂质,湿法处理阳极泥进行综合利用的流程如下:
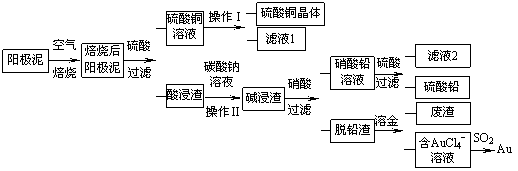

(1)用CuSO4做电解液电解含铜、金、铅的粗铜,阳极的电极反应式有: 和Cu-2e-= Cu2+。
(2)焙烧阳极泥时,为了提高焙烧效率,采取的合理措施是 ,焙烧后的阳极泥中除含金、PbSO4外,还有 (填化学式)。
(3)操作I的主要步骤为 ,操作Ⅱ的名称是 。
(4)写出用SO2还原AuCl4-的离子方程式 。
(5)为了减少废液排放、充分利用有用资源,工业上将滤液1并入硫酸铜溶液进行循环操作,请指出流程图中另一处类似的做法 。
(6)已知298K时,Ksp(PbCO3)=1.46×10-13,Ksp(PbSO4)= 1.82×10-8,用离子方程式表示加入碳酸钠溶液的作用 。
查看答案和解析>>
科目:高中化学 来源: 题型:
从薄荷油中得到一种烃A(C10H16),叫ɑ—非兰烃,与A相关反应如下:
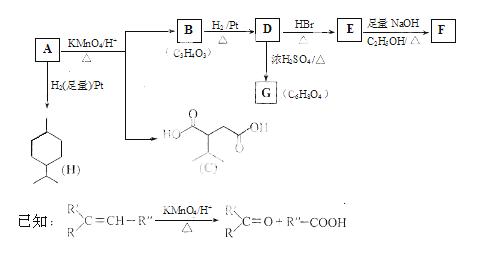
(1)H的分子式为 。
(2)B所含官能团的名称为  。
。
(3)含两个—COOCH3基团的C的同分异构体共有 种(不考虑手性异构),其中核磁共振氢谱呈现2个吸收峰的异构体结构简式为 。
(4)B→D,D→E的反应类型分别为 、 。
(5)G为含六元环的化合物 ,写出其结构简式: 。
,写出其结构简式: 。
(6)F在一定条件下发生聚合反应可得到一种高级吸水性树脂,该树脂名称为  。
。
(7)写出E→F的化学方程式: 。
(8)A的结构简式为 ,A与等物质的量的Br2进行加成反应的产物共有 种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.所有复合材料都由基体和增强体两部分组成
B.复合材料的化学成分可能只有一种也可能含有多种
C.基体在复合材料中起骨架作用
D.将复合材料按基体分类,可分为树脂基复合材料、金属基复合材料和纤维增强复合材料
查看答案和解析>>
科目:高中化学 来源: 题型:
“哥伦比亚号”航天飞机的失事原因之一是覆盖在航天飞机外层的一片微不足道的隔热瓦脱离,引起飞机外表金属温度迅速升高而熔化解体。
其中照片显示,在“哥伦比亚号”机翼下方有几片小瓷片脱落,引起了科学家的注意,这是一种覆盖在航天飞机表面的特殊的陶瓷片,其主要作用是________。
A.增加航天飞机的强度,防止流星和太空垃圾撞击而损坏航天飞机
B.将太阳能转化为电能供航天飞机使用
C.便于雷达跟踪,接受地面指挥中心的指令
D.在返回大气层时,陶瓷耐高温隔热,有效地保护航天飞机平安返回地面
(2)隔热瓦是一种金属陶瓷,金属陶瓷是由陶瓷和黏结金属组成的非匀质的复合材料。下列关于复合材料的说法不正确的是________。
A.由两种或两种以上金属(或金属与非金属)熔合而成的物质叫复合材料
B.复合材料一般具有强度高、质量轻、耐高温、耐腐蚀等优异功能,在综合性能上超过了单一材料
C.玻璃钢是以玻璃纤维和树脂组成的复合材料,它可做船体,汽车车身等,也可做印刷电路板
D.复合材料的熔、沸点一般比它的各组成成分的熔、沸点低
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应A(g)+B(g)C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
| t/2 | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.反应在前5 s的平均速度v(A)=0.17 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH>0
C.相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用勒夏特列原理解释的是 ( )
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
C.向氯水中加CaCO3后,溶液漂白性增强
D.用排饱和食盐水法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应反应来制备甲醇。
I:CH4 ( g ) + H2O ( g ) =CO ( g ) + 3H2 (g ) △H =+206.0 kJ·mol-1
II:CO ( g ) + 2H2 ( g ) = CH3OH ( g ) △H =—129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
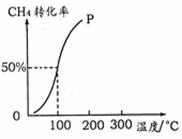 (2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的
关系如右图。
①假设100 ℃时达到平衡所需的时间为5 min,
则用H2表示该反应的平均反应速率为 。
②100℃时反应I的平衡常数为 。
(3)在压强为0.1 MPa、温度为300℃条件下,将a mol CO与
3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 ▲ (填字母序号)。
A.c ( H2 )减少 B.正反应速率加快,逆反应速率减慢 C.CH3OH 的物质的量增加 D.重新平衡c ( H2 )/ c (CH3OH )减小 E.平衡常数K增大
(4)写出甲醇—空气—KOH溶液的燃料电池负极的电极反应式: 。
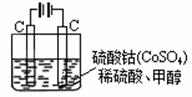 (5)甲醇对水质会造成一定的污染,有一种电化学法可消除
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除
这种污染,其原理是:通电后,将Co2+氧化成Co3+,
然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。
实验室用右图装置模拟上述过程:
① 写出阳极电极反应式 。
② 写出除去甲醇的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com