
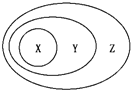
| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 溶液 | 分散系 | 混合物 |
| B | 铜 | 金属元素 | 元素 |
| C | 强电解质 | 电解质 | 化合物 |
| D | 置换反应 | 氧化还原反应 | 离子反应 |
| A. | A | B. | B | C. | C | D. | D |
科目:高中化学 来源: 题型:解答题
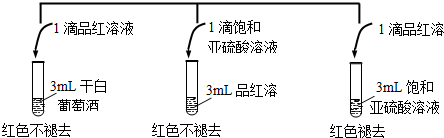
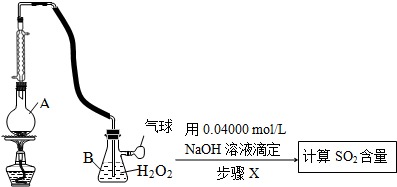
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
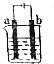 如图a、b均为铂电极,电解一段时间后,烧杯中溶液的pH增大,则选用的电解质溶液可以是( )
如图a、b均为铂电极,电解一段时间后,烧杯中溶液的pH增大,则选用的电解质溶液可以是( )| A. | H2SO4溶液 | B. | NaCl溶液 | C. | AgNO3溶液 | D. | KOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粉末中一定有Na2O、Na2O2、NaHCO3 | |
| B. | 粉末中一定不含有Na2CO3和NaCl | |
| C. | 粉末中一定含有Na2O和NaHCO3 | |
| D. | 无法肯定粉末里是否含有NaHCO3和NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1NaHCO3溶液中:C6H5O-、K+、Na+、Cl- | |
| B. | 使甲基橙显红色的溶液中:ClO-、I-、Ca2+、Mg2+ | |
| C. | 澄清透明溶液中:Al3+、S2-、NO3-、Cu2+ | |
| D. | 0.1 mol•L-1KMnO4溶液中:H+、SO32-、SO42-、Mn2+、H2C2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Ca2+)、c(OH-)均增 | B. | c(Ca2+)、c(OH-)均保持不变 | ||
| C. | c(Ca2+)、c(OH-)均减小 | D. | 溶液质量增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com