
 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.分析 (1)反应热=反应物总键能-生成物总键能,据此计算;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
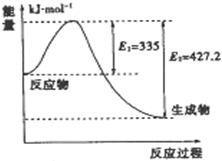
(3)分析图象N2和H2反应生成2mol NH3过程中能量变化示意图可知反应放热427.2KJ-335KJ=92.2KJ,每生成1mol NH3放出热量46.1KJ.
解答 解:(1)反应热=反应物键能总和-生成物键能总和得到:436kJ/mol+243kJ/mol-2E(H-Cl)=-185kJ/mol,解得E(H-Cl)=432KJ/mol,
故答案为:432KJ/mol;
(2)①2Cu(s)+$\frac{1}{2}$O2(g)═Cu2O(s)△H=-169kJ•mol-1,
②C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1,
③2Cu(s)+O2(g)═2CuO(s)△H=-314kJ•mol-1
依据盖斯定律②+①-③得到C(s)+2CuO(s)═Cu2O(s)+CO(g)△H=+34.5KJ/mol;
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为C(s)+2CuO(s)═Cu2O(s)+CO(g)△H=+34.5KJ/mol,
故答案为:C(s)+2CuO(s)═Cu2O(s)+CO(g)△H=+34.5KJ/mol;
(3)图象分析可知,N2和H2反应生成2mol NH3过程中能量变化示意图可知反应放热427.2KJ-335KJ=92.2KJ,每生成1mol NH3放出热量46.1KJ;
故答案为:46.1kJ.
点评 本题考查反应热的有关计算,熟悉以化学键键能、盖斯定律计算反应热的方法是解题关键,注意热化学方程式书写方法和注意事项,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 同周期的ⅡA族与ⅢA族元素的原子序数一定相差1 | |
| B. | 镁、铝、铜、铁、钠五种金属元素中,铜和铁属于过渡元素 | |
| C. | 元素的非金属性越强,其气态氢化物水溶液的酸性越强 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨工业是我省开磷集团的重要支柱产业之一.氨是一种重要的化工原料,在工农业生产中有广泛的应用.
合成氨工业是我省开磷集团的重要支柱产业之一.氨是一种重要的化工原料,在工农业生产中有广泛的应用.| 化学键 | N-H | N≡N | Br-Br | H-Br |
| 键能/kJ•mol-1 | 391 | 946 | 194 | 366 |
| 时间/min | CH4(mol) | H2O(mol) | CO (mol) | H2 (mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | a | 0.80 | c | 0.60 |
| 7 | 0.20 | b | 0.20 | d |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
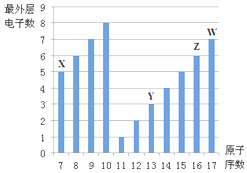 如图是部分短周期元素最外层电子数与原子序数的关系图.
如图是部分短周期元素最外层电子数与原子序数的关系图.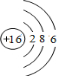 .
.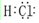 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气的结构式:N=N | B. | F-的结构示意图: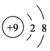 | ||
| C. | 中子数为20 的氯原子:2017Cl | D. | NH3 的电子式: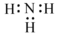 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol•L-1NaClO溶液中,ClO-的数目为0.1NA | |
| B. | 常温常压下,11.2LCH4含有的共用电子对数目为2NA | |
| C. | 16gO2与O3混合气体中,氧原子的数目为1.5NA | |
| D. | 1molFe与足量Cl2完全反应后,转移的电子数目为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com