
(16分) 碳及其化合物有广泛的用途。
(1)反应C(s)+ H2O(g)  CO(g) +H2(g) ΔH= +131.3 kJ?mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
CO(g) +H2(g) ΔH= +131.3 kJ?mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
A.增加碳的用量 B.升高温度 C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+ CO2(g) 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1
则反应 CO(g)+H2O(g) CO2(g)+H2(g) 的△H= kJ?mol-1。
CO2(g)+H2(g) 的△H= kJ?mol-1。
(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为 。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
t / min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
①其它条件不变,降低温度,达到新平衡前v(逆)_____v(正)(填“>”、“<”或“=”) 。
②该温度下,此反应的平衡常数K=__________;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数______(填“增大”、“减小”或“不变”)。
(1)BC(4分,答1个对的得2分,全对得4分,见错0分)
(2)- 41.2(3分,没有“-”扣1分,数据算错得0分,全对得3分)
(3)CH3OH‑6e-+ H2O=CO2+6H+ (2分)
(4)① < (2分); ②K=9/25或0.36(3分) ;③不变 (2分)
【解析】
试题分析:(1)A.碳是固体,增加碳的用量平衡不移动,氢气转化率提高,A正确;B.正方应吸热,升高温度,平衡向正反应方向进行,氢气转化率升高,B正确;C.用CO吸收剂除去CO,降低生成物浓度,平衡向正反应方向进行,氢气转化率升高,C正确;D.催化剂不能影响平衡状态,因此加入催化剂氢气转化率不变,D错误,答案选BC。
(2)已知①C(s)+ CO2(g) 2CO(g) △H=+172.5kJ?mol-1,②C(s)+ H2O(g)
2CO(g) △H=+172.5kJ?mol-1,②C(s)+ H2O(g)  CO(g) +H2(g) ΔH= +131.3 kJ?mol-1,则由盖斯定律可知②-①得到反应 CO(g)+H2O(g)
CO(g) +H2(g) ΔH= +131.3 kJ?mol-1,则由盖斯定律可知②-①得到反应 CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2 kJ?mol-1。
CO2(g)+H2(g) △H=-41.2 kJ?mol-1。
(3)原电池中负极失去电子,发生氧化反应,则甲醇在负极通入。由于溶液显酸性,则负极电极反应式为CH3OH‑6e-+ H2O=CO2+6H+。
(4)①正方应是放热反应,降低温度平衡向正反应方向进行,则其它条件不变,降低温度,达到新平衡前v(逆) <v(正)。
② CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L) 0.08 0.08 0 0
平衡浓度(mol/L) 0.03 0.03 0.03 0.03
转化浓度(mol/L) 0.05 0.05 0.03 0.03
所以该温度下,此反应的平衡常数K=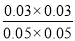 =0.36
=0.36
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),则相当于增大压强,反应前后体积不变,则平衡不移动,所以平衡时CO的体积分数不变。
考点:考查盖斯定律的应用、外界条件对平衡状态的影响以及平衡状态的有关计算


科目:高中化学 来源:2015届广东省佛山市高三10月月考化学试卷(解析版) 题型:选择题
下列关于钠及其氧化物的叙述中,正确的是
A.金属钠的硬度较大,密度较小,能浮在水面上
B.Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
C.钠易与空气中的水、氧气等物质反应,所以通常将它保存在煤油里
D.钠是银白色金属,放置在空气中表面变暗是由于生成了过氧化钠
查看答案和解析>>
科目:高中化学 来源:2015届广东省中山市高三上学期第二次模拟考试化学试卷(解析版) 题型:选择题
在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法错误的是( )

A.NO2是红棕色气体
B.NO和O2必须在催化剂表面才能反应
C.汽车尾气的主要污染成分包括CO和NO
D.催化转化总反应为:2NO+O2+4CO  4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源:2015届广东省中山市等五校联考高三第一学期化学试卷(解析版) 题型:选择题
下列离子方程式中正确的是( )
A.往CaCl2溶液中通入少量的CO2: Ca2++ CO2+ H2O === CaCO3↓+ 2H+
B.向碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+ OH-=== CO32-+ H2O
C.向AlCl3溶液中加入过量的浓氨水:Al3+ + 4NH3·H2O === A1O2- + 4NH4+ + 2H2O
D.钠与水的反应:2Na + 2H2O === 2Na+ + 2OH- + H2↑
查看答案和解析>>
科目:高中化学 来源:2015届广东省中山市等五校联考高三第一学期化学试卷(解析版) 题型:选择题
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:
3NF3+5H2O===2NO+HNO3+9HF。下列有关说法正确的是( )
A.NF3既是氧化剂,又是还原剂
B.还原剂与氧化剂的物质的量之比为1∶2
C.若生成0.2 mol HNO3,则转移0.2 mol电子
D.NF3在潮湿的空气中泄漏会产生无色气体
查看答案和解析>>
科目:高中化学 来源:2015届广东省东莞市高三第一次调研考试理科化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列叙述正确的是(Fe 56)
A.1mol?L-1 NaHCO3溶液中的Na+数为NA
B.常温时,2.24LCO2所含的氧原子数为0.2NA
C.5.6g Fe与足量稀盐酸反应,转移电子数为0.2NA
D.标准状况下,2.24L CCl4所含分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源:2015届广东省七校高三上学期第一次联考理综化学试卷(解析版) 题型:填空题
(16分)氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。 利用FeO/Fe3O4循环制氢,已知:
H2O(g)+3FeO(s) Fe3O4(s) + H2(g) △H=a KJ/mol (Ⅰ)
Fe3O4(s) + H2(g) △H=a KJ/mol (Ⅰ)
2Fe3O4(s)=6FeO(s) + O2(g) △H=b KJ/mol (Ⅱ)
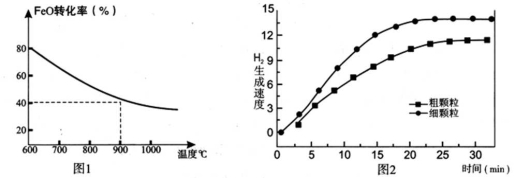
下列坐标图分别表示FeO的转化率(图1)和一定温度时,H2生成速率[细颗粒(直径0.25 mm),粗颗粒(直径3 mm)](图2)。
(1)反应:2H2O(g)=2H2(g) + O2(g) ΔH= (用含a、b代数式表示);
(2)在上述循环制氢的过程中FeO的作用是: ;
(3)900°C时,在两个体积均为2L密闭容器中分别投入0.60molFeO和0.20mol H2O(g),甲容器用细颗粒FeO,乙容器用粗颗粒FeO。
①用细颗粒FeO和粗颗粒FeO时,H2生成速率不同的原因是: ;
②用细颗粒FeO时,H2O (g)的转化率比用粗颗粒FeO时H2O(g)的转化率 (填“大”或“小”或“相等”);
③求此温度下该反应的平衡常数K(写出计算过程)。
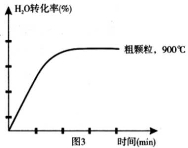
(4)在坐标图3中画出在1000°C、用细颗粒FeO时,H2O(g)转化率随时间变化示意图(进行相应的标注):
查看答案和解析>>
科目:高中化学 来源:2015届山东省邹城市高三10月月考化学试卷(解析版) 题型:填空题
(10分)某澄清溶液,可能含有NH4+、Mg2+、Al3+、Na+、Cu2+、OH-、Cl-、I-、NO3-和SO42-等离子中的几种,现进行如下实验:
①在试管中取少许溶液,滴加几滴石蕊试液,溶液呈红色。
②另取原溶液少许,加入足量CCl4,在不断振荡的条件下加入足量氯水,静置,上层接近无色,下层呈紫红色。
③向②所得水溶液中加入AgNO3溶液,有白色沉淀生成。
④另取原溶液,滴加NaOH溶液,得白色沉淀;继续加入NaOH溶液至过量,沉淀部分溶解,过滤后给滤液加热,有刺激性气味的气体产生。
(1)由此判断原溶液中一定有大量的 离子。
(2)步骤②反应的离子方程式是________________________________
(3)步骤④中沉淀溶解的离子方程式是
(4)还不能确定的阳离子是 ,如何检验?(写出实验名称及判断依据的现象)
____________________________________________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com