
分析 (1)摩尔质量在数值上等于其相对分子质量;
(2)根据n=$\frac{m}{M}$计算磷酸物质的量;
(3)每个磷酸分子中含有8个原子,则n(原子)=8n(H3PO4),再根据N=nNA计算原子个数.
解答 解:(1)摩尔质量在数值上等于其相对分子质量,磷酸相对分子质量为98,则磷酸的摩尔质量是98g/mol,故答案为:98g/mol;
(2)n(H3PO4)=$\frac{4.9g}{98g/mol}$=0.05mol,故答案为:0.05mol;
(3)每个磷酸分子中含有8个原子,则n(原子)=8n(H3PO4)=8×0.05mol=0.4mol,则原子数目=0.4mol×NA/mol=0.4NA,
故答案为:0.4NA.
点评 本题考查物质的量有关计算,为高频考点,明确物质的量公式中各个物理量的关系即可解答,注意摩尔质量与相对分子质量关系,题目难度不大.


科目:高中化学 来源: 题型:填空题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 (10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
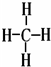 ;③和⑤形成的化合物的电子式
;③和⑤形成的化合物的电子式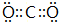 ;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式
;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式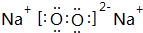 ;
; ,比较R的阴离子与②的阳离子半径大小(写离子符号)S2->K+
,比较R的阴离子与②的阳离子半径大小(写离子符号)S2->K+查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z+1 | B. | Z+11 | C. | Z+25 | D. | Z+32 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 可以利用如图所示的装置测定不同浓度的硫酸与锌的反应速率.
可以利用如图所示的装置测定不同浓度的硫酸与锌的反应速率.| 序号 | 加入的稀硫酸浓度 | 反应时间/min | 收集的气体/mL | 反应速率/mL•min-1 |
| ① | 1mol/L | 11 | 10 | 0.91 |
| ② | 2mol/L | a | 10 | b |
| ③ | 4mol/L | 2 | 10 | 5.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 得到的盐酸的物质的量浓度为$\frac{\frac{42.3L}{22.4L/mol}}{1.0L}$≈1.9mol•L-1 | |
| B. | 得到的盐酸的密度为$\frac{\frac{42.3L}{22.4L/mol}×36.5g/mol+1000g}{1000mL}$≈1.069g•cm-3 | |
| C. | 得到的盐酸的质量分数为$\frac{\frac{42.3L}{22.4L/mol}×36.5g/mol}{\frac{42.3L}{22.4L/mol}×36.5g/mol+1000g}$×100%≈6.4% | |
| D. | 缺少数据,不能计算所得盐酸的物质的量浓度、密度及质量分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com