
为增强金属制品的抗蚀性能,需要对金属进行表面处理。如图为铝的阳极氧化法表面处理技术原理示意图,可使铝制品表面生成一层致密的氧化膜。则下列说法不正确的是( )

A.阳极反应为2Al+3H2O-6e-===Al2O3+6H+
B.阴极反应为2H++2e-===H2↑
C.电解一段时间后溶液的pH升高
D.表面生成的致密的氧化膜不溶于稀硫酸
 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
某合成气的主要成分是一氧化碳和氢气,可用于合成甲醚等清洁燃料。由天然气获得该合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1=+206.1 kJ·mol-1
②CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH2=+247.3 kJ·mol-1
③CO(g)+H2O(g)CO2(g)+H2(g) ΔH3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示。
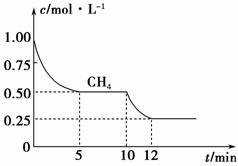
图1
反应进行的前5 min内,v(H2)=________;10 min时,改变的外界条件可能是______________________________________________________________。
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中CH4的转化率随时间的变化如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图像。
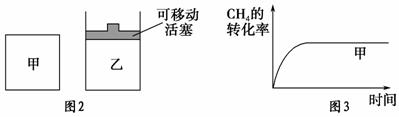
(3)反应③中ΔH3=________。800 ℃时,反应③的平衡常数K=1,测得该温度下密闭容器中某时刻各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应③中正、逆反应速率的关系式是________(填代号)。
a.v正>v逆 B.v正<v逆
c.v正=v逆 D.无法判断
(4)用该合成气制取甲醚的化学方程式为______________________________。
该反应的原子利用率为________(设反应完全进行,用质量百分比表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了确定乙醇分子的结构简式是CH3—O—CH3还是CH3CH2OH,实验室利用右图所示的实验装置,
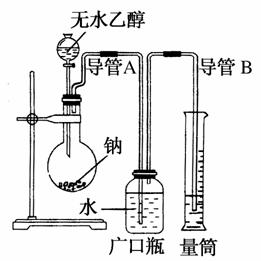
测定乙醇与钠反应(ΔH<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子数目。试回答下列问题:
(1)指出实验装置的错误______________________________________。
(2)若实验中用含有少量水的乙醇代替相同质量的无水乙醇,相同条件下,测得氢气的体积将________(填“偏大”“偏小”或“不变”),原因是____________________________________________。
(3)请指出能使实验安全、顺利进行的关键实验步骤(至少指出两个关键步骤)______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式2H2(g)+O2(g)===2H2O(l)
ΔH1<0,则关于2H2O(l)===2H2(g)+O2(g) ΔH2的说法不正确的是( )
A.方程式中化学计量数表示分子数
B.该反应的ΔH2应大于零
C.该反应的ΔH2=-ΔH1
D.该反应可表示36 g液态水完全分解生成气态氢气和氧气的热效应
查看答案和解析>>
科目:高中化学 来源: 题型:
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。

(1)a电极材料为__________,其电极反应式为__________。
(2)电解液d可以是__________,则白色沉淀在电极上生成;也可以是__________,则白色沉淀在两极之间的溶液中生成。
A.纯水 B.NaCl溶液
C. NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是__________,在加入苯之前,对d溶液进行加热处理的目的是_______________________________。
(4)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中不存在氢键的是 ( )。
A.冰醋酸中醋酸分子之间
B.液态氟化氢中氟化氢分子之间
C.一水合氨分子中的氨分子与水分子之间
D.可燃冰(CH4·8H2O)中甲烷分子与水分子之间
查看答案和解析>>
科目:高中化学 来源: 题型:
下图为几种晶体或晶胞的示意图:
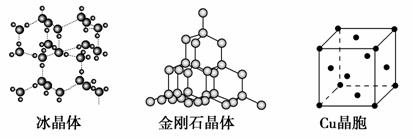
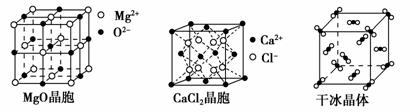
请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_______。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能______(填“大于”或“小于”)MgO晶体,原因是_________________。
(4)每个Cu晶胞中实际占有________个Cu原子,CaCl2晶体中Ca2+的配位数为________。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)按系统命名法填写下面有机物的名称:
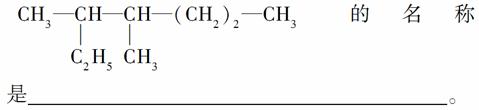
(2)2,6二甲基4乙基辛烷的结构简式是______________________________,1 mol该烃完全燃烧需消耗氧气________mol。
(3)在烃的分子结构中,若每减少2个氢原子,则相当于碳碳间增加1对共用电子对。试完成下列问题:
①分子式为CnH2n+2的烃分子中碳碳间共用电子对数为________。
②符合该条件的单烯烃的分子式为________。
(4)  分子式为________,按碳的骨架分,该有机物属于________。(填字母序号)
分子式为________,按碳的骨架分,该有机物属于________。(填字母序号)
a. 环状化合物 b. 脂环烃
C. 芳香化合物 d. 苯的同系物
(5)2,2二甲基丙烷的习惯命名为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com