
在容积不变的密闭容器中存在如下反应:
2SO2(g)+O2(g) 2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是 ( )
2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是 ( )
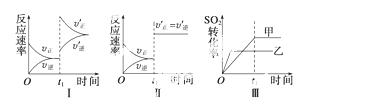
A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是催化剂对化学平衡的影响,且甲的催化效率比乙高
D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
下列物质的俗称、主要成分的化学式及其用途均正确的是
A.磁铁矿——Fe2O3——炼铁 B.胆矾——CuSO4·5H2O——波尔多液
C.蓝宝石——SiO2——饰品 D.纯碱——NaHCO3——焙制糕点
查看答案和解析>>
科目:高中化学 来源: 题型:
配制250 mL 0.1 mol/L HCl溶液时,下列操作会使配得溶液的物质的量浓度偏大的是( )
A.定容后摇匀,发现液面低于刻度线,再加水至刻度线
B.转移液体后未洗涤烧杯
C.在容量瓶中进行定容时,俯视刻度线
D.配制前洗涤好的容量瓶内有少量水
查看答案和解析>>
科目:高中化学 来源: 题型:
已知分解1 mol H2O2放出热量98 kJ。在含少量I-的溶液中,H2O2分解的机理为
H2 O2+I-—→H2O+IO- 慢
O2+I-—→H2O+IO- 慢
H2O2+IO-—→H2O+O2+I- 快
下列有关该反应的说法正确的是( )
A.反应速率与I-浓度有关
B.IO-也是该反应的催化剂
C.反应活化能等于98 kJ·mol-1
D.v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)  2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )
A.反应前2 min的平均速率v(Z)=2.0×10-3 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v逆>v正
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
现欲用碳酸钙固体和稀盐酸反应制取CO2气体。请回答下列问题。
(1)写出发生反应的离子方程式:_________________________________________。
(2)实验过程中绘制出生成CO2的体积V(CO2)与时间t的关系如下图所示。试分析判断OE段、EF段、FG段反应速率[分别用v(OE)、v(EF)、v(FG)表示]的大小关系为____________;比较OE段和EF段,说明EF段速率变化的主要原因:
________________________________________________________________________。
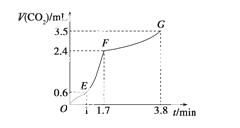
查看答案和解析>>
科目:高中化学 来源: 题型:
把0.10 mol CH3COONa加到1.0 L 0.10 mol·L-1 CH3COOH溶液中(设加CH3COONa溶液体积不变),求溶液的pH(已知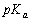 = 4.74)。
= 4.74)。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 18g D2O含有的电子数为10NA
B. 标准状况下,11.2 L SO3中含有的分子数为0.5 NA
C. 7.8 g Na2O2晶体中含有的阴离子数为0.1 NA
D. 常温常压下,44 g CO2气体含有氧原子的个数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D四种元素都是短周期元素,A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne具有相同的电子层排布;5.8 g B的氢氧化物恰好能与100 mL 2 mol・L―1盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构中,最外层电子数是次外层电子数的3倍。根据上述条件回答:
(1)元素C位于第__________周期第__________族,它的最高价氧化物的化学式为____________。
(2)A元素是_________,B元素是________,D元素是_______。(填名称)
(3)A与D形成稳定化合物的电子式是_____________,判断该化合物在空气中是否变质的简单方法是_______________________________。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com