
工业生产硝酸铵的流程如下图所示
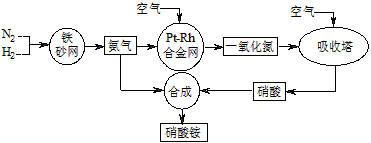
(1)硝酸铵的水溶液呈 (填“酸性”、“中性”或“碱性”);其水溶液中各离子的浓度大小顺序为: 。
(2)已知N2(g)+3H2(g) 2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。
2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。
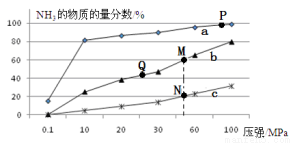
①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是
A.及时分离出NH3可以提高H2的平衡转化率
B.P点原料气的平衡转化率接近100%,是当前工业生产工艺中采用的温度、压强条件
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
D.M点对应的H2转化率是75%
E.如果N点时c(NH3)=0.2 mol·L-1,N点的化学平衡常数K≈0.93
(3)尿素(H2NCONH2)是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为二步反应:第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272 kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138 kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下左图所示:
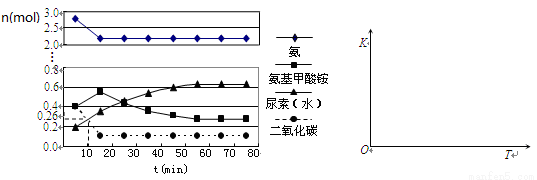
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第__________步反应决定,总反应进行到________min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_______________mol·L-1·min-1。
③在右图中画出第二步反应的平衡常数K随温度的变化的示意图。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届北京市海淀区高三上学期期中测试化学试卷(解析版) 题型:实验题
Na2O2 和NO2 都是中学化学常见的物质,某实验小组对他们之间的反应进行探究。
(1) 小组同学对NO2 与Na2O2 的反应提出以下假设。
假设一:生成NaNO3,反应的化学方程式为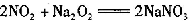
假设二:生成NaNO2,反应的化学方程式为_____________________。
(2) 小组同学在通风橱中制备并收集干燥的NO2 后进行如下实验:

①实验室常利用铜与浓硝酸反应制备NO2,反应的化学方程式为_________。
②有同学根据实验1 中“气球变瘪”的现象推断假设一成立,你认为是否合理并简述理由:_____________。
(3) 小组同学进一步对产物进行检验
查阅资料:
i. Na2O2 与水反应会生成H2O2;
ii. NO2?具有还原性,可用KMnO4 酸性溶液进行检验;
iii. 含NO3?的溶液遇 FeSO4和浓硫酸生成棕色物质[Fe(NO)]2?
进行实验:


①实验2 的主要目的是排出溶液中H2O2 对后续实验的干扰,请补全实验2 的操作______________。
②根据实验3 的现象可得出结论“产物含” NO2?,该实验的现象是__________。
③实验4 中进行步骤②的目的是__________。
(4) 该小组同学由以上全部实验可得出结论:_________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一上11月月考化学试卷(解析版) 题型:选择题
为了预防缺铁性贫血,人体必须保证足够的铁的摄入。这里的“铁”指
A、铁单质 B、铁元素 C、氢氧化铁 D、氧化铁
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省天水市高三上学期期中测试化学试卷(解析版) 题型:选择题
对下列事实的解释正确的是
A.浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定
B.浓硫酸具有吸水性,说明可用浓硫酸干燥氨气
C.足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化Fe2+
D.常温下,可用铝制容器盛装浓硫酸,说明浓硫酸与铝不反应
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上学期第三次月考化学试卷(解析版) 题型:填空题
A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表:
元素 | 相关信息 |
A | 可形成自然界硬度最大的单质 |
B | 与A元素同周期,核外有三个未成对电子 |
C | 最外层电子数是其电子层数的3倍 |
D | 第一电离能至第四电离能分别是I1=578KJ/mol,I2=1817KJ/mol,I3=2745KJ/mol, I4=11575KJ/mol |
E | 常温常压下,E的单质是固体,其氧化物是形成酸雨的主要物质 |
F | F的一种同位素的质量数为63,中子数为34 |
(1)A、B、C元素的第一电离能由大到小的顺序为 (用元素符号表示)。F的基态原子核外电子排布式为 。
(2)AE2是一种常用的溶剂,是 (填“极性”或“非极性”)分子,分子中σ键与π键个数比为 。
(3)写出D与NaOH溶液反应的离 子方程式 。DB形成的晶体与金刚石类似,它属于 晶体。B的最简单氢化物容易液化,理由是
子方程式 。DB形成的晶体与金刚石类似,它属于 晶体。B的最简单氢化物容易液化,理由是

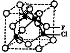
(4)已知F的晶体结构如图所示,又知F的密度为9.00g·cm-3,则晶胞边长为 ;FEC4常作电镀液,其中EC42-的空间构型是 ,其中E原子的杂化轨道类型是 。
(5)F的一种氯化物晶胞体结构如图所示,该氯化物的化学式是 。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省嘉兴市高三上学期期中测试化学试卷(解析版) 题型:选择题
以下反应最符合绿色化学原子经济性要求的是
A.乙烯聚合为聚乙烯高分子材料
B.甲烷与氯气制备一氯甲烷
C.以铜和浓硝酸为原料生产硝酸铜
D.用SiO2制备高纯硅
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏银川市高一上学期期中测试化学试卷(解析版) 题型:选择题
下列溶液中的氯离子浓度与50 mL 1 mol /L的AlCl3溶液中氯离子浓度相等的
A.150 mL 2 mol /L的KCl
B.75 mL 2 mol /L的CaCl2
C.150 mL 1 mol /L的NaCl
D.75 mL 3 mol /L的NH4Cl
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省台州市高二上学期第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-= Cl2↑
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- = 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜
D.钢铁发生电化腐蚀的正极反应式:Fe-2e- = Fe2+
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上学期第二次模拟理综化学试卷(解析版) 题型:选择题
某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的

A.溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+
B.溶液中一定不含CO32-和NO3-,一定含有SO42-
C.溶液中c(NH4+)=0.3 mol/L
D.c(H+)∶c(Al3+)∶c(Mg2+)=1∶1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com