
| A. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫 | |
| B. | 将盛有二氧化氮和四氧化二氮混合气的密闭容器置于冷水中,混合气体颜色变浅- | |
| C. | 向氯水中加CaCO3后,溶液漂白性增强 | |
| D. | 500℃左右比室温更有利于合成NH3 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.开启啤酒瓶后,瓶中马上泛起大量泡沫,是压强对其影响导致的,属于可逆过程,可以用平衡移动原理解释,故A不选;
B.二氧化氮和四氧化二氮混合气体的密闭容器置于冷水中,化学平衡向着生成四氧化二氮的方向进行,颜色变浅,能用勒夏特利原理解释,故B不选;
C.依据氯水中的化学平衡为Cl2+H2O?HCl+HClO,加入碳酸钙和盐酸反应促进平衡正向进行,次氯酸浓度增大,漂白性增强,和平衡有关,能用勒夏特利原理解释,故C不选;
D.合成氨放热,温度升高,平衡逆向移动,所以500℃左右比室温不利于合成氨的反应,不能用勒夏特列原理解释,故D选;
故选D.
点评 本题考查了勒夏特列原理的应用,注意影响化学平衡的因素,本题难度中等.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸氢钠的水解:HSO3-+H2O?H3O++SO32- | |
| B. | 甲烷燃料电池(电解质为KOH)负极反应:CH4-8e-+2H2O═CO2+8H+ | |
| C. | 1mol•L-1 NH4A1(SO4)2溶液中逐滴加入等体积4 mol•L-1 NaOH溶液:Al3++4OH-═AlO2-+2H2O | |
| D. | 用硫酸铜溶液去除硫化氢气体Cu2++H2S═CuS↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
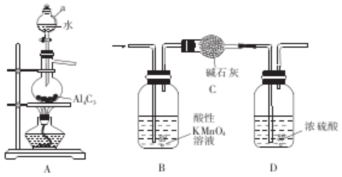
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X气体 | Y溶液 | 预测的现象 | 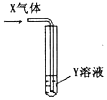 | |
| ① | CO2 | 饱和Na2CO3溶液 | 白色沉淀析出 | |
| ② | SO2 | Ba(NO3)2溶液 | 白色沉淀析出 | |
| ③ | NH3 | AgNO3溶液 | 白色沉淀析出 | |
| ④ | NH3 | AlCl3溶液 | 白色沉淀析出 |
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
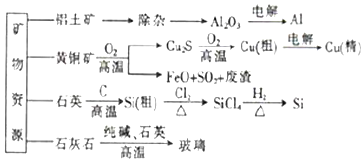
| A. | 制取玻璃和粗硅的同时均产生CO2气体 | |
| B. | 生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应 | |
| C. | 粗硅制高纯硅时,提纯四氯化硅可用过滤的方法(SiCl4的熔点-70℃,沸点57.7℃) | |
| D. | 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2在反应中被还原 | |
| B. | NaClO3在反应中失去电子 | |
| C. | H2SO4在反应中作氧化剂 | |
| D. | 1 mol氧化剂在反应中得到1 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ②③⑤ | C. | ④⑤ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡 常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
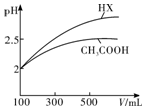
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com