
| A. | 硅、锗都位于金属与非金属的交界处,都可以做半导体材料 | |
| B. | 氢化物的沸点:H2O>NH3>HF | |
| C. | 同主族元素从上到下,单质的熔点逐渐降低 | |
| D. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 |
分析 A、位于金属与非金属的交界处的元素具有半导体的性质;
B、根据范德华力对物质性质的影响结合H2O、NH3、HF中含有氢键分析;
C、根据卤族元素自上而下单质熔沸点升高,碱金属自上而下单质熔沸点降低;
D、非金属性越强最高价氧化物对应水化物的酸性越强.
解答 解:A、位于金属与非金属的交界处的元素具有半导体的性质,硅、锗都位于金属与非金属的交界处,都可以做半导体材料,故A正确;
B、组成和结构相似的分子,相对分子质量越大,分子间作用力越强,物质的熔沸点越高,H2O、NH3、HF属于分子晶体,但H2O、NH3、HF中都含有氢键,使得沸点变大,每个H2O中含有2个氢键,每个NH3中含有1个氢键,每个HF中含有1个氢键,且氟的非金属性强于氮,所以氢化物的沸点:H2O>HF>NH3,故B错误;
C、卤族元素自上而下单质熔沸点升高,碱金属自上而下单质熔沸点降低,所以同主族元素的单质的熔点从上到下不一定逐渐降低,故C错误;
D、非金属性越强最高价氧化物对应水化物的酸性越强,P的非金属性强于Si,所以H3PO4比H2SiO3的酸性强,故D正确;
故选AD.
点评 本题考查同周期元素性质递变规律和差异性,比较基础,注意从原子结构理解金属性、非金属性递变规律.


科目:高中化学 来源: 题型:选择题
| A. | 青蒿素的一个分子中含有42个原子 | |
| B. | 青蒿素属于无机物 | |
| C. | 青蒿素的相对分子质量为282 | |
| D. | 青蒿素中碳元素的质量分数约为63.8% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应的本质是元素化合价发生了改变 | |
| B. | 失电子的物质被还原 | |
| C. | 某元素从化合物状态变成单质状态,该元素一定被还原 | |
| D. | 氧化还原反应中,氧化剂和还原剂可能是同一种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向FeBr2溶液中通入少量Cl2 | 溶液由浅绿色变为黄色 | 氧化性:Cl2>Br2 |
| B | 向Na2SO3溶液中滴加盐酸 | 有气体产生 | 非金属性:Cl>S |
| C | 向pH=3的HA和HB溶液中分别加水稀释至100倍 | pH(HA)>pH(HB) | 酸性:HA>HB |
| D | 向重晶石中加入饱和碳酸钠溶液 | 重晶石逐渐溶解 | 溶度积:Ksp(BaCO3)<Ksp(BaSO4) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
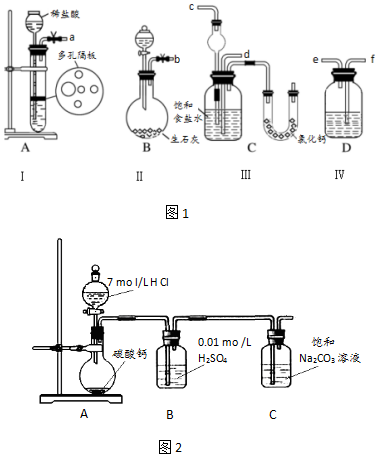
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Cl2通入氯化亚铁溶液 Fe2++Cl2=Fe3++2Cl- | |
| B. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2 Fe3++2 Br2+6 Cl | |
| C. | 少量Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 铜与浓硝酸的反应:Cu+4HNO3=Cu 2++NO3-+2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国目前使用的主要能源仍是化石燃料,它属于不可再生能源 | |
| B. | 太阳能、氢能、风能、地热能、生物质能、沼气能等属于新能源 | |
| C. | 解决能源危机的根本途径是尽可能地节约能源,减少浪费 | |
| D. | 风能是太阳能的一种转换形式,所以风能属于二次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
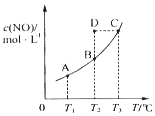 在一固定容积的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)?CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是( )
在一固定容积的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)?CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是( )| A. | 该反应的△H>0 | |
| B. | 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| C. | 若状态B、C、D的压强分别为PB、PC、PD,则 PC=PD>PB | |
| D. | 在T2时,若 反 应 体 系 处于 状 态D,则 此 时 v正>v逆 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com