
| A. | 根据上述过程,每生成1molKMnO4,共转移6mol电子 | |
| B. | 第二步电解时,阳极电极反应式为2MnO42--2e-=2MnO4- | |
| C. | 第二步电解的离子方程式为:2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+OH- | |
| D. | 第二步电解时阴极周围pH减小 |
分析 A.根据高锰酸钾和转移电子之间的关系式计算;
B.电解时,阳极上失电子发生氧化反应;
C.第二步电解的离子方程式为:2MnO42-+H2O $\frac{\underline{\;通电\;}}{\;}$2MnO4-+H2↑+2OH-;
D.电解时,阴极上得电子发生还原反应.
解答 解:A.将方程式2MnO2+4KOH+O2$\frac{\underline{\;250℃\;}}{\;}$2K2MnO4+2H2O和2K2MnO4+H2O $\frac{\underline{\;通电\;}}{\;}$2KMnO4+H2↑+2KOH相加得2MnO2+4KOH+O2=2KMnO4+H2↑+2KOH+H2O,每生成1mol KMnO4共转移电子的物质的量=1mol(7-4)=3mol,故A错误;
B.第二步电解时,锰酸钾在阳极上失电子生成高锰酸钾,阳极电极反应式为2MnO42--2e-=2MnO4-,故B正确;
C.第二步电解的离子方程式为:2MnO42-+H2O $\frac{\underline{\;通电\;}}{\;}$2MnO4-+H2↑+2OH-,故C错误;
D.第二步电解时,阴极上氢离子得电子生成氢气,所以阴极附近有氢氧根离子生成,则溶液pH增大,故D错误;
故选B.
点评 本题考查了氧化还原反应及电解原理,明确电解时阴阳上放电的离子及元素化合价是解本题关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中2molNO与1molO2充分反应后,容器内气体的分子数为2NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含4molSi-O键的二氧化硅晶体中氧原子数为2NA | |
| B. | 标准状况下,含3NA个σ键的甲醛分子所占的体积约为22.4L | |
| C. | 2molNO和1molO2混合,在密闭容器中充分反应,容器内的分子数小于2NA | |
| D. | 1molFe与一定量的硝酸反应,转移的电子数为0.2NA~0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
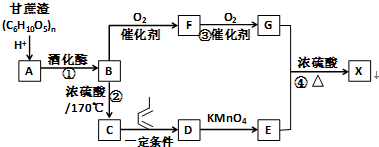
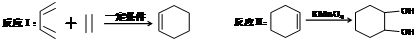
 ,F官能团的名称为醛基,
,F官能团的名称为醛基,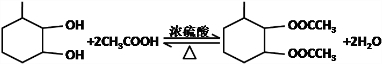 .
. Ⅰ.含六元环Ⅱ.能使溴的四氯化碳溶液褪色
Ⅰ.含六元环Ⅱ.能使溴的四氯化碳溶液褪色 的合成路线为
的合成路线为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| B. | 外电路中电子由c电极流向VB2电极 | |
| C. | 电解过程中,c电极表面先有红色物质析出,后有气泡产生 | |
| D. | 若B装置内的液体体积为100 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾是一种常用的化学试剂,当高锰酸钾晶体结块时,应在研钵中用力研磨,以得到细小晶体,有利于加快反应或溶解的速率 | |
| B. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 | |
| C. | 油脂制肥皂实验中加乙醇的目的是增大油脂的溶解度从而增大与氢氧化溶液的接触面积,从而加快油脂皂化反应速率 | |
| D. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L | B. | 11.2L | C. | 44.8L | D. | 89.6L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com