
【题目】某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)
A. 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-="==" Cl-+ ClO-+ H2O
B. 该消毒液的pH约为12:ClO-+ H2O![]() HClO+ OH-
HClO+ OH-
C. 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2↑+H2O
D. 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+CH3COO—
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 电解饱和食盐水可制取烧碱、氯气、氢气
B. 从海水中可提取镁、溴、碘等物质
C. 粗铜(含少量Zn、Fe、Pt等)电解精炼后,溶液中金属阳离子只有Fe2+、Zn2+
D. 在镀件上镀铜,镀件作阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用阴离子交换膜和过滤膜制备高纯度的Cu的装置示意图,下列有关叙述不正确的是
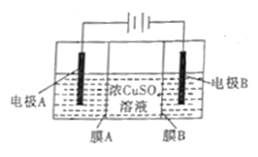
A. 电极A是粗铜,电极B是纯铜
B. 电路中通过1mol电子,生成32g铜
C. 溶液中SO42-向电极A迁移
D. 膜B是过滤膜,阻止阳极泥及杂质进入阴极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表为我们提供了许多关于元素的重要信息,是学习化学和研究化学的重要工具。元素周期表中某个小方格的内容如图所示,下列叙述不正确的是

A.“26”表示该元素原子的相对原子质量
B.“Fe”是该元素的元素符号
C.该元素是一种金属元素
D.该元素的名称是铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁与4mol·L-1的稀硫酸反应(放热反应)生成H2的物质的量与反应时间的关系如图所示。下列结论正确的是

A.反应开始2min内平均反应速率最大
B.常温下,改用98.3%的浓硫酸可以加快反应速率
C.反应在2~4min间生成H2的平均反应速率为0.1mol·L-1·min-1
D.2~4min内反应速率逐渐增大,说明2~4min内温度比浓度对反应速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列化工生产流程的说法不正确的是
①铁矿石、焦炭、石灰石、空气、生铁
②黄铜矿![]() Cu2S
Cu2S![]() Cu(粗)
Cu(粗)![]() Cu(精)
Cu(精)
③石英![]() Si(粗)
Si(粗)![]() SiCl4
SiCl4![]() Si(高纯)
Si(高纯)
④![]()
A. ①的主要设备是炼铁高炉,生产过程中产生的高炉煤气主要成分是![]() 等,形成的炉渣中某成分可用作生产普通玻璃
等,形成的炉渣中某成分可用作生产普通玻璃
B. ②中电解精炼铜时,粗铜中的杂质全部沉积在阳极区,由![]() 组成的电解液需循环更换
组成的电解液需循环更换
C. ③中粗硅与![]() 反应后,可用分馏的方法提纯
反应后,可用分馏的方法提纯![]()
D. ④中Ⅰ、IV两步转化后的气体均需循环以提高原料的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)含11.2 g KOH的稀溶液与1 L0.1mol/L的H2SO4溶液反应放出11.46 kJ的热量,该反应表示中和热的热化学方程式为___________________。
(2)将0.40 mol N2O4气体充入2 L的恒容密闭容器中发生如下反应:N2O4(g) ![]() 2NO2(g)ΔH。在T1℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
2NO2(g)ΔH。在T1℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
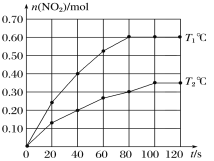
①T1℃,40~80 s内用N2O4表示该反应的平均反应速率为________mol/(L·s)。
②ΔH________0(填“>”、“<”或“=”)。
(3)向甲、乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g)![]() xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
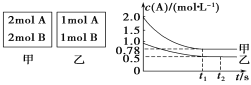
①甲容器平衡后物质B的转化率为_______;
②T℃ 时该反应的平衡常数为________。
(4)在25 ℃下,将a mol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。
①则溶液显________性(填“酸”“碱”或“中”);
②用含a的代数式表示NH3·H2O的电离常数Kb=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室中进行化学实验按右图甲,连接好线路发现灯泡不亮,按右图乙连接好线路发现灯泡亮,下列结论一定正确的是( )
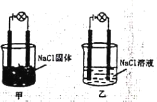
A.NaCl固体是非电解质而NaCl溶液是电解质
B.在通电的条件下,NaCl在水中电离出大量的离子而导电
C.相同条件下,向乙的NaCl溶液中逐滴滴加硝酸银溶液,溶液导电性先减弱后增强
D.甲的NaCl固体中无自由移动的阴阳离子,因此不能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。
(1)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为______。
②图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知:______________法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是______。
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
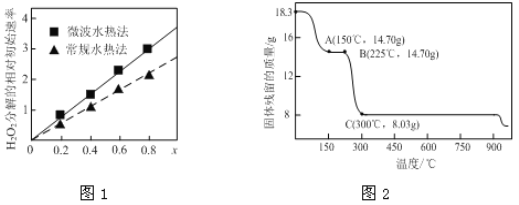
①通过计算确定A点剩余固体的化学成分为________________(填化学式)。试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式:_________________________________________。
②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com