
| ||
| ||


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
A、2KClO3
| ||||
B、3CO+Fe2O3
| ||||
C、3Mg+2NH3
| ||||
| D、Na2CO3+Ca(OH)2=CaCO3↓+2NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在制备硝酸钾晶体实验中先常温减压过滤,后高温常压过滤 |
| B、在中和热测定的实验中,将氢氧化钠和盐酸混合反应后的最高温度作为末温度 |
| C、火柴头中的氯元素检验的实验中,将火柴头(未燃烧)浸于水中,片刻后取少量溶液,加AgNO3溶液、稀硝酸,若出现白色沉淀,证明有氯元素 |
| D、原电池实验中,可以往电解质溶液中加入一些还原剂增强电池的放电效果(去极化作用) |
查看答案和解析>>
科目:高中化学 来源: 题型:
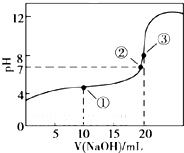 常温下,用0.1mol/L溶液滴定20mL 0.1mol/L CH3COOH溶液的滴定曲线如图.下列说法正确的是( )
常温下,用0.1mol/L溶液滴定20mL 0.1mol/L CH3COOH溶液的滴定曲线如图.下列说法正确的是( )| A、滴定过程中不可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| B、点①所示溶液中c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
| C、点②所示溶液中c(CH3COOH)>c(Na+)=c(CH3COO-)>c(H+)=c(OH-) |
| D、点③所示溶液中c(Na+)+c(H+)=c(CH3COOH)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,当关闭K时,向A(恒容)中充入1mol X、1mol Y,向B(带有活塞)中充入2mol X、2mol Y,起始时,V(A)=V(B)=aL.在相同温度和催化剂存在的条件下,两容器中各自发生下列反应:2X(g)+2Y(g)?Z(g)+2W(g)△H<0,达到平衡(Ⅰ)时,V(B)=0.8aL.请回答:
如图所示,当关闭K时,向A(恒容)中充入1mol X、1mol Y,向B(带有活塞)中充入2mol X、2mol Y,起始时,V(A)=V(B)=aL.在相同温度和催化剂存在的条件下,两容器中各自发生下列反应:2X(g)+2Y(g)?Z(g)+2W(g)△H<0,达到平衡(Ⅰ)时,V(B)=0.8aL.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
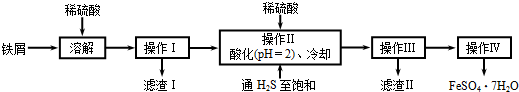
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制备硫酸亚铁铵的实验中最后制得的晶体过滤后用蒸馏水洗涤 |
| B、AgI 沉淀中滴入稀KCl溶液,有白色沉淀出现,说明AgCl比AgI更难溶 |
| C、倾析法是将不溶物充分沉淀后,先转移沉淀后转移液体 |
| D、配制好的氢氧化钠溶液用邻苯二甲酸氢钾滴定浓度时,采用酚酞为指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
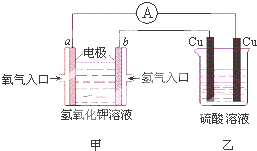 根据如图所示的装置(甲中电极均为惰性电极),判断下列叙述中正确的是( )
根据如图所示的装置(甲中电极均为惰性电极),判断下列叙述中正确的是( )| A、利用该反应可持续产生硫酸铜直至硫酸耗尽 | ||||
| B、甲中a电极的电极反应为:O2+4H++4e-=2H2O | ||||
C、装置开始工作初期乙中的总反应为:Cu+H2SO4
| ||||
| D、反应过程中甲、乙装置中溶液的pH都逐渐减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com