
分析 (1)基态Cr3+离子的电子排布式为1s22s22p63s23p63d3;基态25Mn2+离子的电子排布式为1s22s22p63s23p63d5;基态28Ni2+离子的电子排布式为1s22s22p63s23p63d8;
(2)把硅酸盐写成二氧化硅和其它氧化物形式,要保证原子总数和化合价不变,按化合价分别写化学式;
(3)Fe属于26号元素,Fe2+的核外有24个电子;因为3d轨道再失去一个电子后就成了半充满的结构,根据洪特规则,这种结构,能量低,较稳定,所以,Fe2+容易失去一个电子,易被氧化为Fe3+,印刷行业中就用氯化铁溶液腐蚀铜板,离子方程式为:Cu+2Fe3+═Cu2++2Fe2+;
(4)电镀时将待镀金属作阴极,镀层金属作阳极.
解答 解:(1)因为基态Cr3+离子的电子排布式为1s22s22p63s23p63d3,其3d轨道上有3个未成对电子,基态25Mn2+离子的电子排布式为1s22s22p63s23p63d5,其3d轨道上有5个未成对电子,基态28Ni2+离子的电子排布式为1s22s22p63s23p63d8,其3d轨道上有2个未成对电子,所以含未成对电子数最多的是25Mn2+离子,故答案为:25Mn2+;
(2)把硅酸盐写成二氧化硅和其它氧化物形式,要保证原子总数和化合价不变,所以Mg2SiO4改写成氧化物的书写形式为:2MgO•SiO2,故答案为:2MgO•SiO2;
(3)Fe属于26号元素,Fe2+的核外有24个电子,则Fe2+的核外电子排布式为1s22s22p63s23p63d6;因为3d轨道再失去一个电子后就成了半充满的结构,根据洪特规则,这种结构,能量低,较稳定,所以,Fe2+容易失去一个电子,易被氧化为Fe3+,印刷行业中就用氯化铁溶液腐蚀铜板,离子方程式为:Cu+2Fe3+═Cu2++2Fe2+
,故答案为:1s22s22p63s23p63d6;3d轨道再失去一个电子后就成了半充满的结构,根据洪特规则,这种结构,能量低,较稳定,所以,Fe2+容易失去一个电子,易被氧化为Fe3+;Cu+2Fe3+═Cu2++2Fe2+;
(4)电镀时将待镀金属作阴极,镀层金属作阳极,所以给铁制品镀上一层锌,电镀时锌块做电镀池的阳极,故答案为:阳.
点评 本题考查了原子核外电子排布书写及应用,硅酸盐的组成以及电镀原理等知识,难度中等.


科目:高中化学 来源: 题型:解答题
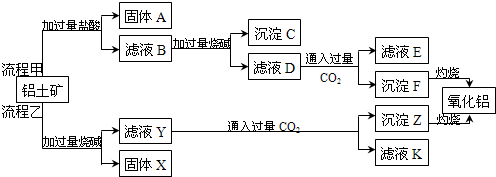
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
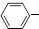 C2H5(g)?
C2H5(g)?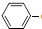 CH=CH2(g)+H2(g)△H=akJ.mol-1.经一段时间后达到平衡.反应过程中测定的部分数据见下表:
CH=CH2(g)+H2(g)△H=akJ.mol-1.经一段时间后达到平衡.反应过程中测定的部分数据见下表:| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 反应在前20 min的平均速率为v(H2)=0.004mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol•L-1,则a<0 | |
| C. | 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0% | |
| D. | 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
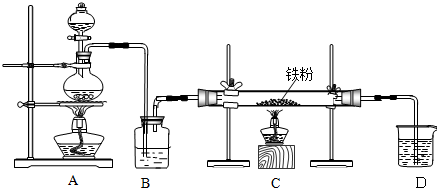
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 生物质能是一种洁净,可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.
生物质能是一种洁净,可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子层序数越大,s原子轨道的形状相同、半径越大 | |
| B. | 在同一电子层上运动的电子,其自旋方向肯定不同 | |
| C. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 | |
| D. | 原子最外层电子排布是5s1的元素,其氢氧化物不能使氢氧化铝溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液中:Cl-、HCO3-、K+、Ba2+ | |
| B. | FeCl3溶液中:K+、NH4+、Br-、SCN- | |
| C. | $\frac{c{(H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、NO3-、K+、Cl- | |
| D. | KMnO4的溶液中:H+、SO42-、CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2mol/L | B. | 1.5mol/L | C. | 1.6mol/L | D. | 2.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子.已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如图所示变化( )
把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子.已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如图所示变化( )| A. | ①②④⑤ | B. | ①②③ | C. | ②③⑤ | D. | ③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com