
| A. | 若混合后溶液中c(H+)>c(OH-),则一定有V1<V2 | |
| B. | 若V1=V2,则二者混合后的溶液中pH>7 | |
| C. | 混合溶液中可能存在:c ( F-)>c (H+)>c (Na+)>c( OH-) | |
| D. | 二者恰好反应完时,则所得溶液中c(F-)=c (Na+) |
分析 常温下pH=12的NaOH溶液的浓度为0.01mol/L,HF溶液中c(H+)=0.01mol•L-1,则HF溶液的浓度大于0.01mol/L,
A.溶液中c(H+)>c(OH-),反应后溶液呈酸性,由于HF浓度大于NaOH溶液,无法判断V1、V2大小;
B.V1=V2时,HF过量,反应后溶液呈酸性;
C.当加入氢氧化钠溶液较少时,该关系可以成立;
D.恰好反应生成是NaF,氟离子水解溶液呈碱性,结合电荷守恒判断.
解答 解:常温下pH=12的NaOH溶液的浓度为0.01mol/L,HF溶液中c(H+)=0.01mol•L-1,则HF溶液的浓度大于0.01mol/L,
A.若混合后溶液中c(H+)>c(OH-),说明反应后溶液呈酸性,由于HF的浓度大于NaOH,则溶液呈酸性时无法比较V1、V2大小,故A错误;
B.若V1=V2,由于HF为弱酸,其浓度大于NaOH溶液,反应后HF过量,溶液呈酸性,则二者混合后溶液的pH<7,故C错误;
C.当加入少量NaOH溶液时,溶液中可以满足:c ( F-)>c (H+)>c (Na+)>c( OH-),故C正确;
D.二者恰好反应完时,反应后溶质为NaF,溶液呈碱性,则c (H+)<c( OH-)根据电荷守恒可知:c(F-)<c (Na+),故D错误;
故选C.
点评 本题考查溶液酸碱性与溶液pH的计算,题目难度中等,明确弱电解质的电离特点为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题有利于提高学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | v(A)=2 mol•L-1•min-1 | B. | v(B)=1.2 mol•L-1•s-1 | ||
| C. | v(D)=0.4 mol•L-1•min-1 | D. | v(C)=0.1 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
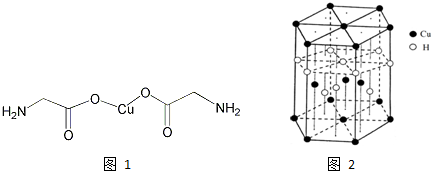
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ②③④ | C. | ②④⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
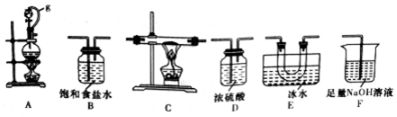
| 实验序号 | 0.1mol/LNaClO溶液/mL | 0.1mol/LNaCl溶液/mL | 0.2mol/LNaOH溶液/mL | H2O/mL | 品红溶液 | 现象 |
| ① | 4.0 | 0 | 0 | x | 3滴 | 较快褪色 |
| ② | 0 | 4.0 | 4.0 | 0 | 3滴 | 不褪色 |
| ③ | 4.0 | 0 | 4.0 | 0 | 3滴 | 缓慢褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油久置会出现油脂的酸败现象,是因为油脂发生了水解 | |
| B. | 有机玻璃、合成橡胶、涤纶都是由加聚反应制得的 | |
| C. | 糖类、油脂、蛋白质的水解产物都是非电解质 | |
| D. | 将已成熟的水果放入未成熟的水果中并密封,可加速水果成熟 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
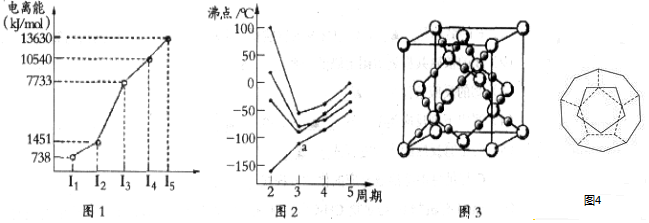
| 离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
| 颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )可用作航空燃料的防震剂、橡胶工业防震剂等.1mol茚满与氧气、氢气反应,最多消耗氧气和氢气的物质的量之比是( )
)可用作航空燃料的防震剂、橡胶工业防震剂等.1mol茚满与氧气、氢气反应,最多消耗氧气和氢气的物质的量之比是( )| A. | 23:3 | B. | 3:23 | C. | 23:6 | D. | 6:23 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com