
【题目】室温下向10mL 0.1molL﹣1NaOH溶液中加入0.1molL﹣1的一元酸HA溶液pH的变化曲线如图所示.下列说法不正确的是( ) 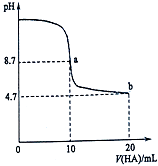
A.在逐滴加入HA溶液至20mL时,NaOH溶液中水的电离程度先增大后减小
B.b点所示溶液中c(A﹣)>c(HA)
C.pH=7时,c(Na+)=c(A﹣)+c(HA)
D.该酸是弱酸
【答案】C
【解析】解:A.氢氧化钠溶液中加入酸HA,开始碱性减弱,水的电离程度增大,加入10mLHA时恰好反应,而后HA过量,在20mL时溶液呈酸性,抑制水的电离,在逐滴加入HA溶液至20mL时,NaOH溶液中水的电离程度先增大后减小,故A正确; B.a点时酸碱恰好中和,溶液pH=8.7,说明HA为弱酸,b点为等浓度NaA、HA混合溶液,溶液呈酸性,说明HA的电离程度大于A﹣的水解程度,则:c(A﹣)>c(HA),故B正确;
C.pH=7时,溶液中c(H+)=c(OH﹣),由电荷守恒可知c(Na+)+c(H+)=c(A﹣)+c(OH﹣),则c(Na+)=c(A﹣),故C错误;
D.a点时酸碱恰好中和,溶液pH=8.7,说明HA为弱酸,故D正确.
故选:C.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】实验室需用2 mol·L-1氯化钠溶液450 mL,配置时应选用容量瓶的规格和称取氯化钠的质量分别是
A. 450 mL,52.7g B.500 mL,58.5g
C.1000 mL,117g D.任意规格,111.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1mol N2O5置于2L密闭容器中,在一定温度下发生下列反应: ①2N2O5(g)2N2O4(g)+O2(g);②N2O4(g)2NO2(g).达到平衡时,c(O2)=0.2molL﹣1 , c(NO2)=0.6molL﹣1 , 则此温度下反应①的平衡常数为( )
A.3.2
B.0.2
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容的密闭容器中充入 0.1mol/L CO2、0.1mol/L CH4 , 在一定条件下发生反应:CH4(g)+CO2(g)2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( ) 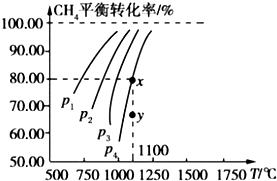
A.1100℃时该反应平衡常数为 1.64
B.压强:p4>p3>p2>p1
C.上述反应的△H<0
D.压强为 p4时,在y点:v 正>v 逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和NOx是主要的大气污染物。某小组认为一定条件下,用NH3与NO2反应转化为无污染物质可进行汽车尾气无害化处理。
(1)氨气的制备
①实验室制氨气的化学方程式为_________。
②制备和收集纯净、干燥的氨气,可以选择下图装置______(填序号),C中试剂为______。

(2)氨气与二氧化氮的反应(已知:2NO2+2NaOH=NaNO3+NaNO2+H2O。)
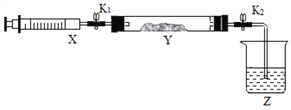
①在硬质玻璃管Y中加入少量催化剂,将NO2气体注入Y管中,Z中应盛装______。
②打开K1,将注射器X中的NH3缓慢注入Y中,发生反应的方程式为_______。
③将注射器活塞退回原处并固定,待装置恢复到室温,打开K2,Y中出现倒吸现象,原因是_________。
(3)该小组进一步研究SO2的性质,探究SO2能否与Na2O2发生氧化还原反应。实验室用铜丝和浓硫酸反应生成SO2的化学方程式为____________。利用(2)中装置,将Y中的药品更换为少量Na2O2,将注射器X中SO2缓慢推入Y中,Y装置中淡黄色粉末变成白色。设计方案检验生成的白色物质中含有SO42-_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C均为气体,在体积为10L的恒容密闭容器中进行发生可逆反应,在0~3分钟内各物质的量的变化情况如图所示.请回答下列问题: 
①反应开始至2分钟时,B的平均反应速率为 .
②该反应的化学反应方程式为
③由图求3min时A的转化率为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com