
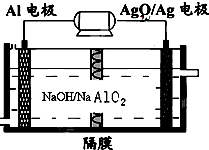
 铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图所示.下列说法正确的是( )
铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图所示.下列说法正确的是( )| A、电池负极反应式2Ag+2OH--2e-=Ag 2O+H2O |
| B、放电时电池负极附近PH减小 |
| C、电池总反应式2Al+3Ag2O+6H+=2Al3++6Ag+3H2O |
| D、电解液中Na+通过隔膜由右向左移动 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl2溶液中通入Cl2 Fe2++Cl2═Fe3++2Cl- |
| B、Fe和稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ |
| C、FeCl3溶液与铜 Fe3++Cu═Fe2++Cu2+ |
| D、用醋酸除水垢 2CH3COOH+CaCO3═2CH3COO-+Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a=b>c>d |
| B、b>a=d>c |
| C、a=b>d>c |
| D、c>a=d>b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KSCN |
| B、K2SO4 |
| C、NaOH |
| D、FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X与Y形成化合物时,X可以显负价,Y显正价 |
| B、最高价含氧酸的酸性:X对应的酸性弱于Y对应的 |
| C、第一电离能可能Y小于X |
| D、气态氢化物的稳定性:HmY小于HnX |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②③ |
| C、①② | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com