
 已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 溶液体积/mL | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
| ① | 常温 | 1 | 40 | 100 | 60 | t1 |
| ② | 常温 | A | B | C | 60 | t2 |
| ③ | 常温 | 3 | 80 | D | E | t3 |
分析 (1)草酸与高锰酸钾反应是锰离子和二氧化碳、水;
(2)根据外界条件对化学反应速率的影响;
(3)根据该实验探究不同的初始pH和草酸溶液浓度对反应速率的影响,所以KMnO4的浓度不变,探究外界条件对反应速率的影响,需保证其他条件相同时来实验;
(4)实验①和②只有pH不同,其它条件都相同;
解答 解:(1)草酸与高锰酸钾反应是锰离子和二氧化碳、水,其反应的离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;
故答案为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;
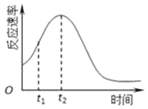
(2)对于该反应,影响化学反应的速率只有温度和催化剂,所以反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:反应放热,温度升高或产物Mn2+是反应的催化剂;
故答案为:此反应放热,温度升高,化学反应速率加快;生成物中的锰离子(或硫酸锰)为此反应的催化剂;
(3)根据该实验探究不同的初始pH和草酸溶液浓度对反应速率的影响,实验要求控制KMnO4溶液初始浓度相同,则KMnO4溶液的体积为100mL,总体积为200mL,则C=100,D=100,B=40,E=20,探究外界条件对反应速率的影响,需保证其他条件相同,则①与②的pH不同,②与③的草酸浓度不同,
则A=3,
故答案为:3;100;20;
(4)实验①和②只有pH不同,其它条件都相同,而且t1<t2,说明其他条件相同时,溶液的初始pH越小,该反应的反应速率越快;
故答案为:其他条件相同时,溶液的初始pH越小,该反应的反应速率越快;
点评 本题主要结合实验考查了影响化学反应速率的因素,题目难度中等,注意温度、浓度、催化剂对化学反应速率的影响,在探究外界条件对反应速率的影响时,必须保证其他影响反应速率的条件一致.


科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:选择题
在下列各组的比较中,前者比后者大的是
A.同温度、同浓度的NaCl溶液和氨水的导电能力
B.25℃时,pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度
C.25℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度
D.25℃时,pH均为3的盐酸和FeCl3溶液中水的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L稀硫酸 | ||
| 1 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |

| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
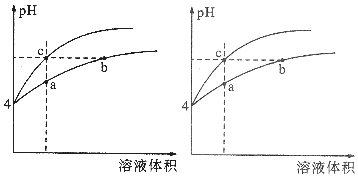 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )| A. | a、c两点溶液的导电能力相同 | |
| B. | b点溶液中c(H+)+c(NH3•H2O)=c(OH-) | |
| C. | 用等浓度的NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体积Vb>Vc | |
| D. | a、b、c三点溶液中水的电离程度a>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| X | M层的电子数为K层电子数的3倍 |
| Y | 短周期中最活泼的金属元素 |
| Z | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| T | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | 相关信息 |
| M | 非金属元素,其气态氢化物的水溶液呈碱性 |
| A | A的单质与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是内层电子数的三倍 |
| C | 在第三周期中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断减小 | |
| B. | 在铜的精炼过程中,若转移1mol电子,则阳极一定溶解32gCu | |
| C. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)△H>0,△S<0 | |
| D. | 将如图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深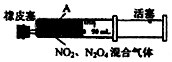 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
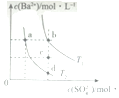
| A. | T1时,c点有沉淀生成 | |
| B. | T2时,蒸发溶剂可能由d点变到b点 | |
| C. | T2时,由a点开始加入BaCl2固体,Ksp增大 | |
| D. | BaSO4的溶解度随温度升高而增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com