
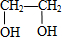 $→_{△}^{浓H_{2}SO_{4}}$ C
$→_{△}^{浓H_{2}SO_{4}}$ C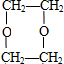 ;
;分析 A可与溴水反应,应含有碳碳双键,则乙醇发生消去反应生成A,A为CH2=CH2,B为CH2BrCH2Br,CH2BrCH2Br发生水解生成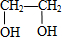 ,C是环状化合物且不能使溴水、KMnO4(H+)溶液褪色,由
,C是环状化合物且不能使溴水、KMnO4(H+)溶液褪色,由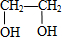 发生分子间脱水生成,为
发生分子间脱水生成,为 ,以此解答该题.
,以此解答该题.
解答 解:A可与溴水反应,应含有碳碳双键,则乙醇发生消去反应生成A,A为CH2=CH2,B为CH2BrCH2Br,CH2BrCH2Br发生水解生成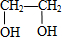 ,C是环状化合物且不能使溴水、KMnO4(H+)溶液褪色,由
,C是环状化合物且不能使溴水、KMnO4(H+)溶液褪色,由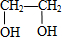 发生分子间脱水生成,为
发生分子间脱水生成,为 ,
,
(1)由以上分析可知A为CH2=CH2,C为 ,故答案为:CH2=CH2;
,故答案为:CH2=CH2; ;
;
(2)A为CH2=CH2,B为CH2BrCH2Br,A发生加成反应生成B,B发生取代反应生成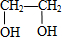 ,故答案为:加成反应;取代反应.
,故答案为:加成反应;取代反应.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,根据物质的结构简式、反应条件结合题给信息进行推断,熟悉常见有机物官能团及其性质关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心就是利用化学原理减少和消除工业生产对环境的污染 | |
| B. | 石油是由多种碳氢化合物组成的混合物 | |
| C. | 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 | |
| D. | 煤的干馏是将煤隔绝空气加强热使之分解的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ①②④⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙二醇 | B. | 丙醇、丁醇 | C. | 丙醇、丙烯 | D. | 丁醇、乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 正极反应为:Zn-2e-═Zn2+ | B. | 电池反应为:Zn+Cu2+═Zn2++Cu | ||
| C. | 当有1mol电子转移时,锌极减轻65g | D. | 盐桥中的K+移向ZnSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-) | |
| B. | 将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,盐酸需加的水量多 | |
| C. | 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+)=c(Cl-) | |
| D. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化氮能使织物褪色,对金属材料也有腐蚀作用 | |
| B. | 亚硝酸盐属于食物防腐剂,可以适量地添加于食物中 | |
| C. | 漂白粉在空气中能稳定存在,可用于漂白纸张 | |
| D. | 大量燃烧化石燃料是造成雾霾天气的重要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸的酯化、丙烯使高锰酸钾酸性溶液褪色的反应都属于取代反应 | |
| B. | C8H10含苯环的烃的同分异构体有3种 | |
| C. | 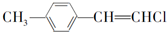 分子中的所有原子不可能共平面 分子中的所有原子不可能共平面 | |
| D. | 莽草酸(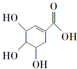 )能与溴水发生取代反应而褪色 )能与溴水发生取代反应而褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com