
【题目】目前海水提溴的最主要方法之一是空气吹出法,其部分流程图如下:
![]()
以下推断不合理的是( )
A. 热空气能吹出溴是利用溴易挥发的性质
B. SO2吸收溴的反应方程式:SO2+2H2O+Br2=H2SO4+2HBr
C. 流程中循环利用的物质有SO2、Br2、Cl2等
D. 没有采用直接蒸馏含Br2的海水得到单质溴主要是为了节能
科目:高中化学 来源: 题型:
【题目】Co(CH3COO)2·4H2O(乙酸钴)是一种重要的有机化工原料。回答下列问题:
(1)以工业品氧化钴(CoO)为原料制备乙酸钴。(已知CoO与CH3COOH溶液反应缓慢,Co2+能与H+、NO3-大量共存)可能用到的试剂:Na2CO3溶液、CH3COOH溶液、HNO3溶液。先将CoO溶于____(填化学式,下同)溶液制得____溶液;在不断搅拌下,向制得的溶液中不断加入____溶液至不再产生沉淀,静置,过滤,洗涤;向沉淀中加入___溶液至沉淀完全溶解,调节pH约为6.8,经一系列操作得Co(CH3COO)2·4H2O。
(2)为探究乙酸钴的热分解产物,先在低于100 ℃时使其脱去结晶水,然后用下列装置进行实验(已知CO能与PdCl2溶液反应生成黑色Pd沉淀):

①通N2的目的是______。
②澄清石灰水和PdCl2溶液分别用于检验CO2和CO,其中盛放PdCl2溶液的装置是____(填字母)。
③实验结束时,为防止倒吸,正确的操作是______。
④装置a中完全反应后得到钴的一种氧化物,固体残留率(![]() ×100%)为45.4%。该氧化物为____。
×100%)为45.4%。该氧化物为____。
⑤装置a在加热过程中没有水生成,最终生成的固体氧化物质量为3.0125 g,装置b和c中的试剂均足量(b、c中得到固体的质量分别为2.5 g、10.6 g),集气瓶中收集到的气体为C2H6和N2,则装置a中发生反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明稀硝酸与铜反应的气体产物是NO,某同学设计了如下实验装置和实验方案。
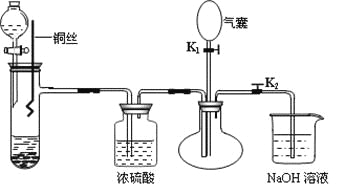
实验步骤:
(1)关闭K1,打开K2,向试管中加石灰石,通过分液漏斗向其中加入一定的稀硝酸,则加入石灰石的作用是________________________________,反应化学方程式是_______________________。
(2)将将铜丝插入稀硝酸中,微热大试管。该步反应离子方程式是________________________。
(3)充分反应后,打开开关K1,通过气囊鼓入空气,可以观察到烧瓶中__________________,证明稀硝酸与铜反应的气体产物是NO。
(4)NaOH溶液的作用__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL含有1mol/L的氯化铝溶液中逐滴加入浓度为1mol/L的氢氧化钠溶液,产生沉淀的物质的量与所加碱的体积如图所示:
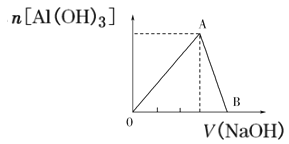
(1)写出OA段和AB段发生反应的离子方程式:OA段_____;AB段_____。
(2)A点溶液中的溶质为:____。(填化学式)
(3)若产生0.78g白色沉淀,则加入的氢氧化钠溶液的体积可能是____mL或____mL。
(4)B点表示的氢氧化钠溶液的体积是___mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol 硫酸钠的溶液恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
A. 0.1(b-2a)mol/LB. 10(2a-b)mol/LC. 10(b-a)mol/LD. 10(b-2a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
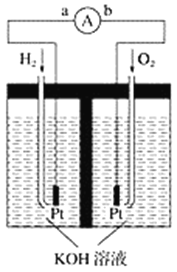
(1)氢氧燃料电池能量转化的主要形式是____________________________________________,在导线中电子流动方向为________(用a、b表示)。
(2)负极反应式为________________________________________________________________。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2===2LiH Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是________。
②金属锂吸收的氢气与放出的氢气的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某2 L恒容密闭容器中加入纳米级氧化亚铜并通入0.1 mol 水(g),发生如下反应:2H2O(g)![]() 2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:
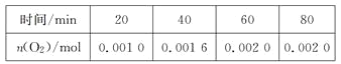
下列说法不正确的是( )
A. 前20 min内的平均反应速率v(H2O)=5×10-5mol·L-1·min-1
B. 达到平衡时,需要从外界吸收的能量为0.968 kJ
C. 增大水的浓度,可以改变待反应的限度
D. 使用纳米级的氧化亚铜,可以增大平衡时氧气的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应4NH3+5O2![]() 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)(单位皆为molL-1min-1)表示,则下列式子中,正确的是( )
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)(单位皆为molL-1min-1)表示,则下列式子中,正确的是( )
A. 4v(O2)=5v(NO)B. 5v(O2)=6v(H2O)
C. 2v(NH3)=3v(H2O)D. 4v(NH3)=5v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A是一种植物生长的调节剂,A进行如图所示的转化可制得有果香味的液体E(C4H8O2)。请回答下列问题:
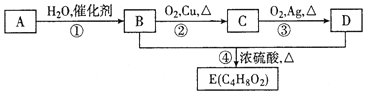
(1)A的电子式为___,D分子中所含官能团的名称为___。
(2)反应①的反应类型是____。
(3)A在一定条件下可以聚生成一种常见塑料,写出该塑料的结构简式___。
(4)请写出反应②的化学方程式__。
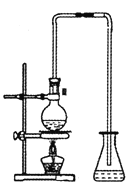
(5)实验室出反应④制备有机物E的装置如图,长导管的作用是导气和___,锥形瓶中盛放的液体是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com