
| 污水中所含离子 | 处理方法 |
| H+或OH- | 中和法 |
| Cu2+、Hg2+ | 沉淀法 |
| CN- | 氧化还原法 |
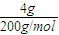 =0.02mol,
=0.02mol,

科目:高中化学 来源: 题型:
| 污水中所含离子 | 处理方法 |
| H+或OH- | 中和法 |
| Cu2+、Hg2+ | 沉淀法 |
| CN- | 氧化还原法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制氯化铜时,是将浓盐酸用蒸气加热至![]() CuCl2+H2O,FeO+2HCl
CuCl2+H2O,FeO+2HCl![]() FeCl2+H2O。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。?
FeCl2+H2O。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。?
(1).为除去溶液中的Fe2+,可以采用的方法是( )?
A.直接加碱,调整溶液pH≥9.6?
B.加纯铜粉,将Fe2+还原出来?
C.先将Fe2+氧化成Fe3+,再调整pH在3~4?
D.通入硫化氢,使Fe2+直接沉淀?
(2).工业上为除去溶液中的Fe2+,常使用NaClO,当向溶液中加入NaClO后,溶液pH变化情况是( )?
A.肯定减小 B.肯定增大?
C.可能减小 D.可能增大?
(3).若此溶液中只含有Fe3+时,要调整pH在3~4之间,此时最好向溶液中加入( )?
A.NaOH溶液 B.氨水?
C.CuCl2溶液 D.CuO固体?
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制氯化铜时,是将浓盐酸用蒸气加热至![]() CuCl2+H2O,FeO+2HCl
CuCl2+H2O,FeO+2HCl![]() FeCl2+H2O。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3—4时,Fe3+以Fe(OH)3的形式完全沉淀。
FeCl2+H2O。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3—4时,Fe3+以Fe(OH)3的形式完全沉淀。
1.为除去溶液中的Fe2+,可以采用的方法是( )
A.直接加碱,调整溶液pH≥9.6 B.加纯铜粉,将Fe2+还原出来
C.先将Fe2+氧化成Fe3+,再调整pH在3—4 D.通入硫化氢,使Fe2+直接沉淀
2.根据信息,工业上为除去溶液中的Fe2+,常使用NaClO,当向溶液中加入NaClO后,溶液pH变化情况是( )
A.肯定减小 B.肯定增大 C.可能减小 D.可能增大
3.根据信息,若此溶液中只含有Fe3+时,要调整pH在3—4之间,此时最好向溶液中加入( )
A.NaOH溶液 B.氨水 C.CuCl2溶液 D.CuO固体
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)有人设计了以下反应途径,假设反应都能进行,你认为最合理的是( )?
A.C3H8![]() C+H2?
C+H2?
B.C3H8![]() C3H6+H2?
C3H6+H2?
C.C3H8+H2O![]() CO+H2?
CO+H2?
D.C3H8+O2![]() CO2+H2O,H2O
CO2+H2O,H2O![]() H2↑+O2↑?
H2↑+O2↑?
(2)按以上最合理的反应途径,理论上用1 mol丙烷最多可制得氨( )?
A.4 mol B.6.7 mol C.10 mol D.2.7 mol
(3)该合理的反应途径最显著的优点是( )?
A.简单易行 B.制得的H2纯度高?
C.制得的H2产量高 D.可同时获得大量热能?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com