
下述实验能达到预期目的的是( )
编号实验内容实验目的
A将含有HCl杂质的CO2通入饱和Na2CO3溶液中除去CO2中的HCl
B将适量一定量的NaNO3和KCl的混合液加热并浓缩至有晶体析出,趁热过滤分离出NaCl晶体
C在淀粉-KI溶液中滴加少量市售食盐配制的溶液鉴别真假碘盐
D将少量Fe(NO3)2试样加水溶解,滴加稀H2SO4酸化,再滴加KSCN溶液检验Fe(NO3)2试样是否变质
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源:2014高考化学苏教版总复习 专题12物质结构与性质练习卷(解析版) 题型:填空题
A、B、C、D、E、F六种元素的原子序数依次递增。
已知:①F的原子序数为25,其余的均为短周期元素;②元素A与元素B同周期,元素A与元素E同主族,且A、B、E三种原子p轨道上均有2个未成对电子;③元素C、D、E在同一周期,且C原子中没有未成对电子。
请回答下列问题:
(1)元素A与元素B的电负性大小比较为:________>________;元素C与元素D的第一电离能的大小比较为:________>________(填入相应的元素符号)
(2)F的核外电子排布式为________。
(3)元素B与元素E形成的晶体所属的晶体类型为________晶体,在该晶体中原子间形成的共价键属于________(从下列选项中选出正确类型)。
A.σ键 B.π键 C.既有σ键,又有π键
(4)由氢元素与A、B两元素共同构成的相对分子质量为30的分子里,中心原子的杂化轨道类型为________,分子的空间构型为________.
(5)根据等电子原理,写出由元素A与元素B构成的一种双原子极性分子的结构式:________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题10化学实验基础练习卷(解析版) 题型:实验题
固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用下图装置(夹持装置略)对其进行探究实验。
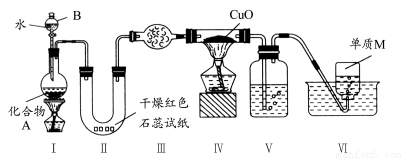
(1)仪器B的名称是________。
(2)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为________;Ⅳ中发生反应的化学方程式为________;V中的试剂为________。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ?Ⅲ?Ⅳ?Ⅱ?V?Ⅵ,此时Ⅱ中现象为________,原因是________。
(4)经上述反应,2.5 g化合物A理论上可制得0.56 L(标准状况)M,则A的化学式为________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题10化学实验基础练习卷(解析版) 题型:选择题
除去下列括号内杂质的试剂或方法错误的是( )
A.HNO3溶液(H2SO4),适量BaCl2溶液,过滤
B.CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气
C.KNO3晶体(NaCl),蒸馏水,结晶
D.C2H5OH(CH3COOH),加足量CaO,蒸馏
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师高考模拟演练练习卷(B)(解析版) 题型:填空题
某探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
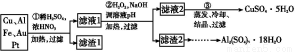
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为 。
(2)第②步加H2O2的作用是 ;
调溶液pH的目的是使 生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是 。
(4)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
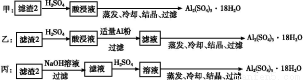
上述三种方案中, 方案不可行,原因是 ;
从原子利用率角度考虑, 方案更合理。
(5)探究小组用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol /L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++H2Y2- CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ;
CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是 。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师高考模拟演练练习卷(A)(解析版) 题型:实验题
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
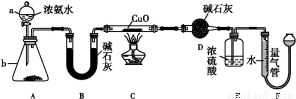
(1)仪器a的名称为 ;仪器b中可选择的试剂为 。
(2)实验室中,利用装置A,还可制取的无色气体是 (填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体产生,上述现象证明NH3具有 性,写出相应的化学方程式: 。
(4)E装置中浓硫酸的作用是 。
(5)读取气体体积前,应对装置F进行的操作: 。
(6)实验完毕,若测得干燥管D增重m g,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为 (用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师高考模拟演练练习卷(A)(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述中一定正确的是( )
A.一定条件下4.6 g Na完全与O2反应生成7.2 g产物,失去的电子数为0.2NA
B.50 mL 18.4 mol/L浓硫酸与足量铜加热反应,生成SO2的分子数为0.46NA
C.一定条件下某密闭容器盛有0.1 mol N2和0.3 mol H2,充分反应后转移电子数为0.6NA
D.电解1 L NaCl溶液至c(OH-)=0.2 mol/L,转移电子数为0.4NA
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 电解质溶液练习卷(解析版) 题型:选择题
下列溶液中有关微粒的物质的量浓度或物理量关系正确的是( )
A.NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HR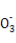 )+2c(R
)+2c(R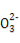 )
)
B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH)
C.常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(N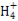 ):①<③<②
):①<③<②
D.等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数:N前>N后
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 化学反应中的能量变化练习卷(解析版) 题型:选择题
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上并压紧(如图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下表(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大:
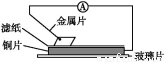
金属 | 电子流动方向 | 电压/V |
甲 | 甲→Cu | +0.78 |
乙 | Cu→乙 | -0.25 |
丙 | 丙→Cu | +1.35 |
丁 | 丁→Cu | +0.30 |
依据记录数据判断,下列结论中正确的是( )
A.将甲、乙形成的合金露置在空气中,甲先被腐蚀
B.金属乙能从硫酸铜溶液中置换出铜
C.在四种金属中丙的还原性最弱
D.甲、丁若形成原电池时,甲为正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com