
【题目】层状复合金属氢氧化物(简称“层状氢氧化物”),主体层板由二元(或多元)金属氢氧化物层构成,层间阴离子可以被其他阴离子取代,因此可以作为离子交换剂,在材料、化工、医药和环境保护等方面有着广泛的用途。镁铝碳酸根型水滑石是人们最早发现的层状氢氧化物。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最小的是___________(填标号)。
A. B.
B. C.
C.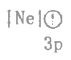 D.
D.
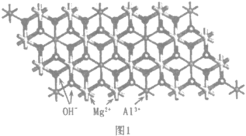
(2)一种水滑石的化学式为Mg4Al2(OH)12CO3H2O.其层板结构如图1。CO32-中碳的杂化类型是____。在图中最小的一个二维菱形晶胞(以图中Al为顶点)中含有___________个Al3+。每个镁氧八面体周围有_______________个相邻铝氧八面体和_______________个相邻镁氧八面体。
(3)水滑石中氢氧化物层的OH-和层间阴离子间的主要作用力为_______________,水滑石作为离子交换剂,去除水体中阴离子去除效果依次为:PO43->CrO42->NO3-,其原因是___________
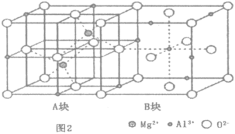
(4)当加热到一定温度时,水滑石类化合物会发生分解,部分产物转化为尖晶石结构的MgxAlyOz,晶体结构如图2所示,它的化学式为___________;A块、B块均为边长为apm的立方体,设阿伏加德罗常数为NA,则最近的两个Al离子之间的距离为___________pm,密度为___________gcm-3(列出计算表达式)。
【答案】D sp2 1 3 3 氢键 阴离子带电荷越高,受到吸引力越强 MgAl2O4 ![]() a
a ![]()
【解析】
(1)根据电子排布图得出粒子状态,3p轨道的电子能量高于3s,第二电离能大于第一电离能,据此分析解答;
(2)计算CO32-中C原子的价电子对数和孤电子对数,判断C原子的杂化方式,结合侧板结构图分析各微粒个数;
(3)OH-和层间阴离子间可形成氢键,根据阴离子所带电荷与受到的吸引力之间的关系进行分析解答;
(4)利用均摊法计算晶胞中个原子的个数,利用公式![]() ,结合立体几何知识进行计算。
,结合立体几何知识进行计算。
(1)BC微粒都是Mg原子失去一个电子后得到的,但是C微粒能量高于B,稳定性B>C,所以失电子能量B>C;AD都是原子,但是A是基态、D是激发态,能量:D>A,稳定性A>D,所以失去一个电子能量:A>D;B为Mg+、A为Mg原子,B再失去电子所需能量就是Mg原子的第二电离能,A失去一个电子的能量是Mg原子的第一电离能,其第二电离能大于第一电离能,所以电离最外层一个电子所需能量B>A,因此,电离最外层一个电子所需能量最小的是D,故答案为:D。
(2)CO32-中C原子的价电子对数为![]() ,不含孤电子对,则其杂化类型为sp2杂化,在图1中,以图中Al为顶点,最小的一个二维菱形晶胞中含有1个Al3+。每个镁氧八面体周围有3个相邻铝氧八面体和3个相邻镁氧八面体,故答案为:sp2;1;3;3;
,不含孤电子对,则其杂化类型为sp2杂化,在图1中,以图中Al为顶点,最小的一个二维菱形晶胞中含有1个Al3+。每个镁氧八面体周围有3个相邻铝氧八面体和3个相邻镁氧八面体,故答案为:sp2;1;3;3;
(3)水滑石中的氢氧化物层的OH-和层间阴离子间可形成氢键,由于阴离子带电荷越高,受到吸引力越强,阴离子所带电荷数PO43->CrO42->NO3-,所以水滑石作为离子交换剂,去除水体中阴离子去除效果依次为:PO43->CrO42->NO3-,故答案为:氢键;阴离子带电荷越高,受到吸引力越强;
(4)根据晶胞结构示意图可知,O2-占据晶胞的顶点、面心、棱心和体心,其个数为![]() ,Mg2+位于晶胞的体内,个数为2,Al3+位于晶胞的体内、棱心和面心,其个数为
,Mg2+位于晶胞的体内,个数为2,Al3+位于晶胞的体内、棱心和面心,其个数为![]() ,因此其化学式为MgAl2O4,已知A块、B块均为边长为apm的立方体,则最近的两个Al离子之间的距离为
,因此其化学式为MgAl2O4,已知A块、B块均为边长为apm的立方体,则最近的两个Al离子之间的距离为 ,一个晶胞的质量
,一个晶胞的质量![]() ,体积V=2a3×10-30cm3,则密度
,体积V=2a3×10-30cm3,则密度 ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
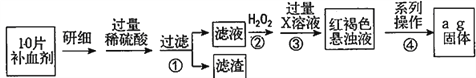
请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置______。![]() 的中子数为________。
的中子数为________。
已知:P(s,白磷)=P(s,黑磷) ΔH=-39.3 kJ·mol-1;P(s,白磷)=P(s,红磷) ΔH=-17.6 kJ·mol-1;由此推知,其中最稳定的磷单质是________。
(2)氮和磷氢化物性质的比较:热稳定性:NH3________PH3(填“>”或“<”)。沸点:N2H4________P2H4(填“>”或“<”),判断依据是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室里制取少量FeCl3,可按照一定顺序连接下图中所列装置,所通过的气体过量且反应充分。试回答以下问题:

(1)实验时,各装置接口的连接顺序为___________________________(用a、b、c、d等字母表示);
(2)C装置的作用是________________________;
(3)D装置的作用是_____________________________________;
(4)检验B装置中反应后铁是否有剩余的方法是:_______________________;
(5)用此方法可制得无水氯化铁。你认为能否改用Fe和盐酸反应,再通入过量氯气、蒸干溶液的方法来制取无水氯化铁,________(答:是或否);说明理由:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)
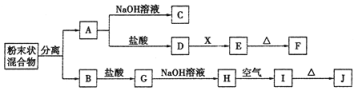
(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能正确表示下列变化的离子方程式的是
A.MnO2与浓盐酸加热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B.FeCl2溶液在空气中变质:12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓
C.NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32-
D.R-NH2电离:R-NH2+H2O![]() R-NH3++OH-
R-NH3++OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。下列说法正确的是
A.2C+SiO2![]() 2CO↑十Si,则每生成4.48 L CO时转移电子0.4NA
2CO↑十Si,则每生成4.48 L CO时转移电子0.4NA
B.1 mol NH3完全溶于水,则n(NH3·H2O)+n(NH4+)=l mol
C.氯化铝在气态时以双聚分子存在,其球棍模型为![]() ,则1 mol双聚分子中含有电子数为128NA
,则1 mol双聚分子中含有电子数为128NA
D.2SO2(g)+O2(g)2SO3(l) △H=-a kJ·mol-1(a>0),则每生成2 mol SO3(l)时吸热a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法中正确的是( )
A. 标准状况下,11.2LCH2Cl2中所含C-Cl键的数目与22.4LHF中所含F原子数目相等
B. 1LpH=13的NaOH溶液中含有OH-的数目一定为0.1NA
C. 1mol过氧化钠分别与足量CO2、SO2反应,转移的电子数均为2NA
D. 10g质量分数为46%的乙醇水溶液中含有的氢原子总数为1.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是
A. H2O(g)===H2+1/2O2(g)ΔH=-485 kJ·mol-1
B. H2O(g)===H2(g)+1/2O2(g) ΔH=+485 kJ·mol-1
C. 2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com