
科目:高中化学 来源:不详 题型:填空题
 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。 CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H 0。(填“>、<或=”下同)
CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H 0。(填“>、<或=”下同)

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 O2(g)=H2O(l) ΔH4;
O2(g)=H2O(l) ΔH4;| A.1个 | B.2个 | C.3个 | D.4个 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.反应过程中能量关系可用右图表示 |
| B.若将该反应设计成原电池锌为负极 |
| C.ΔH的值与反应方程式的计量系数无关 |
| D.若将其设计为原电池当有32.5g锌溶解时, |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 的绝对值均正确)
的绝对值均正确)| A.C2H5OH(l)+3O2(g)= 2CO2(g)+3H2O(g);△H=—1367.0 kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热) |
| C.S(s)+O2(g)= SO2(g);△H=—269.8kJ/mol(反应热) |
| D.2NO2= O2+2NO;△H=+116.2kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO32- |
B.热化学方程式C2H2(g)+ O2(g) O2(g) |
C.铂电极电解MgCl2饱和溶液:MgCl2 |
| D.H+(aq)+OH(aq) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 O2(g) = H2O(l) △H = -285.8 kJ / mol
O2(g) = H2O(l) △H = -285.8 kJ / mol查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
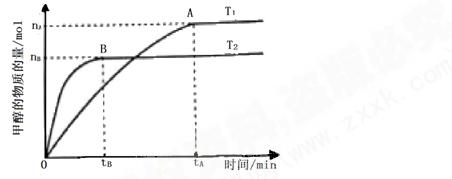
 号)
号) mol·L-1·min-1
mol·L-1·min-1 增大
增大查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属钠与氯气反应生成氯化钠后,其结构的稳定性增强,体系的能量降低 |
B.物质的燃烧可 以看作为“储存”在物质内部的能量(化学能)转化为热能释放出来 以看作为“储存”在物质内部的能量(化学能)转化为热能释放出来 |
| C.氮气分子内部存在着很强的共价键,故通常情况下氮气的化学性质很活泼 |
| D.需要加热才能发生的反应不一定是吸收能量的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com