
【题目】煤燃烧排放的烟气含有NOx,容易形成酸雨污染环境,可通过多种化学方法对烟气进行脱硝处理。回答下列问题:
(1)在无氧条件下,脱硝反应为:6NO(g)+4NH3(g)5N2(g)+6H2O(g)△H=-1807.0kJmol-1,T℃时,在恒容的密闭容器中,测得在不同时间NO和NH3的物质的量如下表:
时间/min | 0 | 1 | 2 | 3 | 4 |
n(NO)/mol | 1.20 | 0.90 | 0.72 | 0.60 | 0.60 |
n(NH3)/mol | 0.90 | 0.70 | 0.58 | 0.50 | 0.50 |
①下列说法正确的是______(填序号)。
A.3min后NO和NH3的浓度都不再变化,反应停止进行
B.前2min内的平均反应速率v(N2)=0.20molL-1min-1
C.达到平衡时NO的转化率为50%
D.及时分离出N2,可使该反应的反应速率增大,平衡正向移动
②若反应开始的压强为p0,则该反应的化学平衡常数Kp=______(可用分数表示;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)在有氧条件下,NOx也能发生脱硝反应。
①已知:N2(g)+O2(g)=2NO(g)△H=180.6kJmol-1
N2(g)+3H2(g)2NH3(g)△H=-92.4kJmol-1
H2O(g)=H2(g)+![]() O2(g)△H=241.8kJmol-1
O2(g)△H=241.8kJmol-1
则脱硝反应4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g)△H=______kJmol-1
②臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)N2O5(g)+O2(g)△H<0,反应在恒容密闭容器中进行,NO2的百分含量随压强(p)、x的变化如图所示:
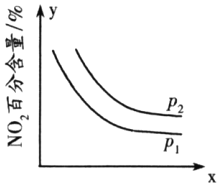
则p1______p2(填“>”“<”或“=”),x表示的物理量除时间外,还可能是______。
(3)利用惰性电极电解也能对烟气进行脱硝处理。电解原理如图所示:
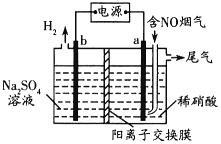
电极a的电极反应式为______,当电解44.8L(标准状况)含5%NO的烟气,理论上电路中通过电子的物质的量为______mol。
【答案】C ![]() p0 -1627.2 > O3的物质的量或其浓度或质量等 NO -3e + 2H2O = NO3 +4H+ 0.3
p0 -1627.2 > O3的物质的量或其浓度或质量等 NO -3e + 2H2O = NO3 +4H+ 0.3
【解析】
(1)①A. 化学反应平衡为动态平衡,正逆反应速率相等但不等于0;
B. 由化学反应速率的定义可知,需要容器的体积;
C. 根据转化率的计算公式得出结论;
D. 反应物或生成物的浓度降低,化学反应速率会减小;
②列出三段式,利用分压表达出化学平衡常数。
(2)①依据热化学方程式和盖斯定律计算得到所需热化学方程式;
②该脱硝反应是气体体积分数减小的反应,增大压强会使平衡向正反应方向移动,导致NO2的百分含量降低,据图分析;根据平衡移动原理进行分析,NO2的百分含量会随着参加反应的O3的量的增大而减少;
(3)依据图中b口放出氢气,可知b为连接电源的负极,作电解池的阴极,则a极发生氧化反应,NO转化为NO3,每消耗1 mol NO,转移电子数为 3 mol,据此计算。
①A. 3min后NO和NH3的浓度都不再变化,说明达到动态平衡,但速率不为零,故A项错误;
B. 容器的体积未知,其化学反应速率无法求出,故B项错误;
C. 3min后NO的浓度不再变化,达到平衡,n(NO) = 0.6 mol,则转化的NO的物质的量 = 1.2 mol-0.6 mol = 0.6 mol,故其转化率 = ![]() ×100% = 50%,故C项正确;
×100% = 50%,故C项正确;
D. 分离出N2,其浓度降低,反应的速率会减小,故D项错误;
故答案选C;
②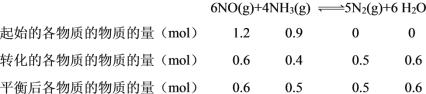
则平衡后H2O的物质的量分数ω(H2O) = ![]() =
= ![]() ,同理可得ω(N2) =
,同理可得ω(N2) = ![]() , ω(NH3) =
, ω(NH3) = ![]() , ω(NO) =
, ω(NO) = ![]() , 反应开始的压强为p0,物质的量为1.2 mol +0.9 mol = 2.1 mol,则反应后的总压p =
, 反应开始的压强为p0,物质的量为1.2 mol +0.9 mol = 2.1 mol,则反应后的总压p = ![]() =
= ![]() ,其平衡常数Kp =
,其平衡常数Kp = 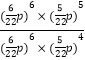 =
= ![]() =
= ![]() =
= ![]() p0,
p0,
故答案为:![]() p0;
p0;
(2)①i.N2(g)+O2(g)═2NO(g)△H=+180.6kJmol-1
ii.N2(g)+3H2(g)=2NH3(g)△H=-92.4kJmol-1
iii.2H2(g)+O2(g)═2H2O(g)△H=-483.6kJmol-1
依据盖斯定律iii×3-ii×2-i×2得到,4O(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H = -1627.2 kJ/mol;
故答案为:-1627.2;
②2NO2(g)+ O3(g) ![]() N2O5(g)+ O2(g),该反应为气体体积减小的反应,因此增大压强平衡会向正向移动,NO2的百分含量降低,从图中可以看出,p1压强大,即p1> p2;增大某一反应物的浓度可以使化学平衡向正反应方向移动,从而提高另一反应物的转化率、减小其百分含量,故x表示的物理量除时间外,还可能是O3的物质的量或其浓度或质量等;
N2O5(g)+ O2(g),该反应为气体体积减小的反应,因此增大压强平衡会向正向移动,NO2的百分含量降低,从图中可以看出,p1压强大,即p1> p2;增大某一反应物的浓度可以使化学平衡向正反应方向移动,从而提高另一反应物的转化率、减小其百分含量,故x表示的物理量除时间外,还可能是O3的物质的量或其浓度或质量等;
故答案为:>;O3的物质的量或其浓度或质量等
(3)根据图示信息可知,b口产生氢气,则为溶液中的氢离子得电子的产物,电解池中阳离子在阴极得电子发生还原反应,故b连接电源的负极,a连接电源的正极,其阳极区NO失电子被氧化为硝酸根离子,发生的电极反应式为:NO -3e + 2H2O = NO3 +4H+,电解的烟气中NO的物质的量 = ![]() = 0.1 mol,所以转移的电子数为0.1mol×3 = 0.3 mol,
= 0.1 mol,所以转移的电子数为0.1mol×3 = 0.3 mol,
故答案为:NO -3e + 2H2O = NO3 +4H+;0.3。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,试管中盛装的是气体呈红棕色,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的可能是
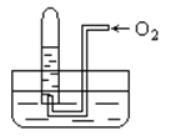
A.可能是N2与NO2的混和气体
B.只可能是NO2一种气体
C.可能是NO与NO2的混和气体
D.可能是H2与NO2的混和气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种常见单萜类化合物的结构如下图所示。下列说法正确的是( )
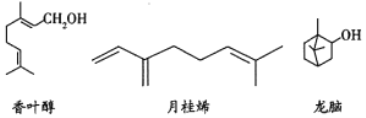
A. 香叶醇和龙脑互为同分异构体,分子式均为![]()
B. 可用金属钠鉴别香叶醇和月桂烯
C. 龙脑分子中所有碳原子在同一个平面上
D. 1mol月桂烯最多能与![]() 发生加成反应
发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯电池是利用锂离子在石墨烯表面和电极之间快速大量穿梭运动的特性而研发的新型可充放电电池,其反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2,其工作原理如下图所示。下列关于该电池的说法正确的是( )
C6+LiCoO2,其工作原理如下图所示。下列关于该电池的说法正确的是( )

A. 充电时,![]() 嵌入
嵌入![]() 中
中
B. 放电时,![]() 极发生的电极反应为
极发生的电极反应为![]()
C. 放电时负极反应为:![]()
D. 充电时,若转移![]() ,石墨烯电极增重7g
,石墨烯电极增重7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于明矾的下列说法错误的是( )
A. 明矾的化学式为KAl(SO4)2
B. 明矾是纯净物
C. 明矾中存在K+和Al3+两种阳离子
D. 明矾是一种复盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A 是由两种元素组成的化合物,质量比为 7:8,在真空中加热分解,生成 B、C。E 是常见的液体,C 和E 高温下能发生反应。F 为日常生活中常见的化合物,E、F 之间的反应常用于工业生产,I 为黄绿色气体单质。
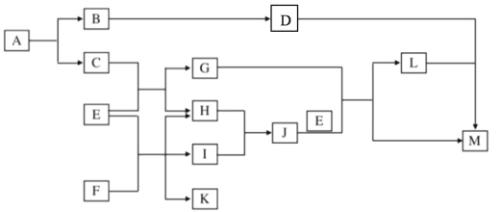
(1)写出 A 的化学式:____
(2)写出 K 的电子式:______
(3)写出 C 和 E 高温下能发生反应的方程式:______
(4)写出 D 和 L 发生反应的离子方程式:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在25 mL 0.1 mol·L-1的NaOH溶液中,逐滴加入0.2 mol·L-1的CH3COOH溶液,溶液的pH与醋酸体积关系如图,下列分析正确的是( )
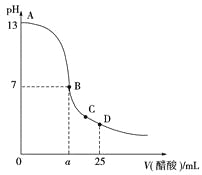
A. B点的横坐标a=12.5
B. C点时溶液中有:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C. D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2c(Na+)
D. 曲线上A、B间的任意一点,溶液中都有:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解饱和食盐水是一项重要的化学工业,请完成下列计算:
(1)当电解产生0.2molNaOH时,能收集到标准状况下的H2____L。
(2)已知室温时饱和食盐水的溶质质量分数为0.265,取200g饱和食盐水进行电解,当NaCl反应了一半时停止电解,
①求出所得混合溶液中NaCl的质量。_____
②求出所得混合溶液中NaOH的质量分数。____(写出计算过程,保留3位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com