
| A、足量Fe在1 mol Cl2中充分燃烧,转移2NA个电子 |
| B、7.8 g Na2O2中阴、阳离子总数为0.4NA |
| C、电解精炼铜时,若转移NA个电子,则阳极减少的质量为32g |
| D、反应KClO3+6HClKCl+3Cl2↑+3H2O中,若有1 mol Cl2生成,转移电子数为2NA |
| 5 |
| 3 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| B、在密闭容器中加入1mol N2和3mol H2,一定条件下充反应生成NH3分子数小于2NA |
| C、将0.1mol FeCl3溶于1L水中,所得溶液含有0.1NA个Fe3+ |
| D、1L 1mol/L的KF溶液中含有F-的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量浓度为1 mol/L的K2SO4溶液中,含2 NA个K+ |
| B、把40 g NaOH固体溶于1 L水中,所得溶液中NaOH的物质的量浓度为1 mol?L-1 |
| C、常温常压下,71 g Cl2含有2 NA个Cl原子 |
| D、标准状况下,11.2 L 氦气中含有的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
| A、原子序数④元素小于⑦元素 |
| B、上述八种元素最高价氧化物对应的水化物,⑤号酸性最强 |
C、⑧号元素离子结构示意图为: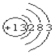 |
| D、②、③处于同一周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:
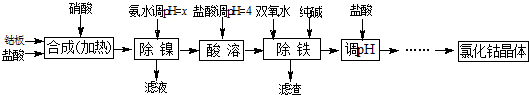
| 化学式 | 沉淀完全时的pH | 钴镍性质 |
| Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3?H2O=Co(OH)2↓+2NH4+ Co2++2H2O?Co(OH)2+2H+ Ni+2HCl=NiCl2+H2↑ Ni2++6NH3?H2O=[Ni(NH3)6]2++6H2O |
| Fe(OH)2 | 9.6 | |
| Fe(OH)3 | 3.7 |
| 加NH3?H2O调pH | 收率/% | Ni2+含量/% |
| 9 | 98.1 | 0.08 |
| 9.5 | 98 | 0.05 |
| 10 | 97.6 | 0.005 |
| 10.3 | 94 | 0.005 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com