
【题目】将一定量的由Cu和Cu2O组成的混合粉末加入到125 mL 2.6 mol·L-1的稀硝酸中,固体完全溶解,得蓝色溶液X并收集到V mL(标准状况)的纯净无色气体Y。下列结论错误的是
A. 纯净无色气体Y与0.75VmL(标准状况)O2混合后通入水中,气体可被完全吸收
B. 若固体与硝酸恰好完全反应,当V=1680时,Cu2O与Cu的物质的量之比为8∶1
C. 原混合粉末的总质量可能为9.8 g
D. 向溶液中加入NaOH溶液,使Cu2+恰好完全沉淀,消耗NaOH的物质的量为(0.325-V/22400)mol
【答案】B
【解析】
125mL2.6molL-1的硝酸的物质的量为:0.125×2.6=0.325mol,固体恰好完全溶解,所以生成单一的硝酸铜溶液,同时产生一氧化氮气体,由此分析解答。
A. 纯净无色气体Y为NO,与0.75VmL(标准状况)O2混合后通入水中,发生反应4NO + 3O2 + 2H2O =4HNO3,恰好完全反应,气体可被完全吸收,故A正确;B、当V=1680时,即一氧化氮的物质的量为:![]() =0.075mol,原混合粉末中Cu和Cu2O的物质的量分别为xmol和ymol,2x+2y=0.075×3,x+2y=
=0.075mol,原混合粉末中Cu和Cu2O的物质的量分别为xmol和ymol,2x+2y=0.075×3,x+2y=![]() ×(0.325-0.075),解之得:x=0.1,y=0.0125,所以原混合粉末中Cu2O与Cu的物质的量之比为1∶8,故B错误;C. 当全部为Cu2O时,硝酸的物质的量为0.325mol,因此溶液中硝酸铜的物质的量最多为
×(0.325-0.075),解之得:x=0.1,y=0.0125,所以原混合粉末中Cu2O与Cu的物质的量之比为1∶8,故B错误;C. 当全部为Cu2O时,硝酸的物质的量为0.325mol,因此溶液中硝酸铜的物质的量最多为![]() =0.1625mol,固体的质量为0.1625mol×144g/mol=23.4g,当全部为Cu时,硝酸的物质的量为0.325mol,发生3Cu+8HNO3=3Cu(NO3)2 +2NO↑+4H2O,只要反应发生均满足题意,即固体质量大于0,因此原混合粉末的总质量不超过23.4g,可能为9.8 g,故C正确;D. 向溶液中加入NaOH溶液,使Cu2+恰好完全沉淀,反应后溶液中的溶质为硝酸钠,根据N原子守恒,消耗NaOH的物质的量为(0.325-
=0.1625mol,固体的质量为0.1625mol×144g/mol=23.4g,当全部为Cu时,硝酸的物质的量为0.325mol,发生3Cu+8HNO3=3Cu(NO3)2 +2NO↑+4H2O,只要反应发生均满足题意,即固体质量大于0,因此原混合粉末的总质量不超过23.4g,可能为9.8 g,故C正确;D. 向溶液中加入NaOH溶液,使Cu2+恰好完全沉淀,反应后溶液中的溶质为硝酸钠,根据N原子守恒,消耗NaOH的物质的量为(0.325-![]() )mol=(0.325-
)mol=(0.325-![]() )mol,故D正确;故选B。
)mol,故D正确;故选B。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】为了除去KCl溶液中少量的MgCl2、MgSO4杂质,可选用Ba(OH)2溶液、稀盐酸和K2CO3溶液三种试剂,按如图步骤操作:
![]()
(1)写出三种试剂的化学式:A____、B____、C____
(2)操作Ⅰ的名称是____。
(3)根据题意,回答下列问题:
①加入过量A的目的是____;
②加入适量C的目的是_____;
③加入B时的化学反应方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l)+3O2(g) ===2CO2(g)+4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) === 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) ===H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______________
(2)甲醇脱氢可制取甲醛CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:

①600K时,Y点甲醇的υ(逆)_____υ(正)(填“>”或“<”)
②若改变条件使之从Y点到X点,则改变条件可以是___________。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(I)和(II)分别进行催化CH3OH的脱氢实验:CH3OH(g)![]() HCHO(g)+H2(g),CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
HCHO(g)+H2(g),CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)=________;实验温度T1_____T2(填“>”、“<”);催化剂的催化效率:实验①________实验②(填“>”、“<”)。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程, 除去甲醇的离子方程式为____________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由碳的氧化物直接合成乙醇燃料已进入大规模生产。下图是由二氧化碳合成乙醇的技术流程:

吸收池中盛有饱和碳酸钾溶液,把含有二氧化碳的空气吹入吸收池中,吸收池中反应液进入分解池后,向分解池中通入高温水蒸汽,把二氧化碳从溶液中提取出来,在合成塔中和氢气经化学反应使之变成可再生燃料乙醇。回答下列问题:
(1)写出吸收池中反应的离子方程式_______________________________________。
(2)除水之外,从分解池中循环使用的物质是_________________________________________。
(3)工业上还采用以CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g)写出该反应的化学平衡常数表达式 K=___________________。
CH3CH2OH(g)+H2O(g)写出该反应的化学平衡常数表达式 K=___________________。
(4)在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数。则由CO制取CH3CH2OH的优点是原料有较大的转化率,由CO2制取CH3CH2OH的优点是_______________________________________________________。
(5)在一定压强下,测得由CO2制取CH3CH2OH的实验数据如下表:

根据表中数据分析:
①温度升高,该反应的平衡常数K值___________________(选填“增大”、“减小”或“不变”)
②提高氢碳n(H2)/n(CO2)比,对生成乙醇___________(选填“不利”、“有利”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,水作为氧化剂的是( )
A. CO+H2O![]() CO2+H2B. CuO+H2
CO2+H2B. CuO+H2![]() Cu+H2O
Cu+H2O
C. 2F2+2H2O═4HF+O2D. 3NO2+H2O═2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①建筑上需要用到大量水泥、玻璃。生产水泥、玻璃中都用到的主要原料为_____(填字母)。
a. 纯碱 b. 石灰石 c. 黏土
②汽车工业大量使用橡胶轮胎,橡胶属于____________(填字母)。
a. 无机非金属材料 b. 金属材料 c. 有机高分子材料
③现代桥梁建造需要使用大量钢材,其中镀锌钢板镀锌的主要目的是_________ (填字母)。
a. 美化桥梁 b. 提高硬度 c. 提高耐腐蚀性
(2)洋蓟被人们冠以“蔬菜之皇”的美称,含有脂肪、蛋白质、糖类、维生素A、维生素C和丰富的钙、磷、铁等元素,其中:
①属于水溶性维生素的是_____________。
②属于人体所需微量元素的是_____________。
③脂肪在人体内水解生成高级脂肪酸和_____________________;糖类在人体中水解生成葡萄糖,写出葡萄糖在人体内氧化的化学方程式:________________________________________________。
(3)合理利用自然资源,防止环境污染和生态破坏。
①向燃煤中加入适量石灰石,可大大减少______________的排放。煤的气化是实现能源清洁化的重要途径,水煤气的主要成分是CO和_____________。
②明矾是一种常用的混凝剂,其净水原理是___________________________ (用离子方程式表示)。污水处理的方法很多,从化学角度看,处理酸性废水可采用________(选填“中和法”或“沉淀法”)。
③我国科学家证明了黄粉虫的幼虫可降解聚苯乙烯(![]() )这类难以自然降解的塑料。请写出由苯乙烯合成聚苯乙烯的化学方程式:__________________________________________。
)这类难以自然降解的塑料。请写出由苯乙烯合成聚苯乙烯的化学方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图所示的物质转化关系中。 C、G、I、M为常见单质,G和M化合可生成最常见液体A,E为黑色粉末,F的焰色反应为黄色,K为白色沉淀,N为红褐色沉淀,I为黄绿色气体,化合物B的摩尔质量为24 g ·mol-1。(部分生成物和反应条件未列出)

(1)L的化学式为______________。
(2)A的电子式为______________。
(3)反应②的离子方程式为____________________________________。
(4)反应③的化学方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480mL含NaClO25%,密度为1.19g/cm3的消毒液.下列说法正确的是
A. 配制过程只需要三种仪器即可完成
B. 容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
C. 定容时俯视容量瓶的刻度线,会造成所配溶液物质的量浓度偏低
D. 需用托盘天平称量的NaClO固体的质量为148.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
热化学方程式 | 平衡常数 | |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
则该温度下,ΔH3=_______________kJmol-1;K3=_____________(用K1和K2表示)。
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则ΔH3 ___(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是_____________;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是______(填“甲”或“乙”),a值为__________。25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,则此时v正_________v逆(填“>”“<”或“=”)

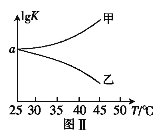
(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com