
 CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 molH2、1 molCO | 1 mol CH3OH | 4 molH2、2 molCO |
| 平衡时n(CH3OH ) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
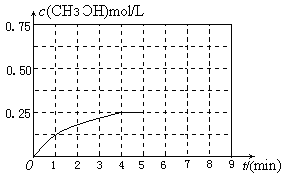

 CH3OH(g)
CH3OH(g) =4;
=4;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题

 CH3OH(g) ΔH1 ②CO2(g)+3H2(g)
CH3OH(g) ΔH1 ②CO2(g)+3H2(g) CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2  CO(g) + 3H2(g) ΔH4。
CO(g) + 3H2(g) ΔH4。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.△H1>0,△H3<0 |
| B.△H2>0,△H4>0 |
| C.△H1=△H2+△H3 |
| D.△H3=△H4+△H5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2mol NH3 |
| 达到平衡的时间/min | | 6 | 8 |
| 平衡时 N2的体积密度 | C1 | 1.5 | |
| 混合气体密度/g·L-1 | 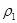 | 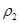 | |
| 平衡常数/ L2·mol-2 | K甲 | K乙 | K丙 |
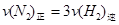 d.混合气体的密度保持不变
d.混合气体的密度保持不变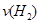 =
= 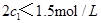 b.氮气的转化率:
b.氮气的转化率: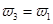 c.
c. 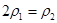 d.
d.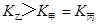
 的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。
的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
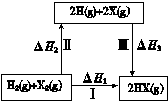
| A.2H(g) +2X(g) ="=" 2HX(g) ΔH3<0 |
| B.途径Ⅰ生成HX的反应热与途径无关,所以ΔH1 = ΔH2 + ΔH3 |
| C.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多 |
| D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H+(aq) +CH3COO-(aq) △H2="+1.3" kJ/mol
H+(aq) +CH3COO-(aq) △H2="+1.3" kJ/mol查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com