
| A. | 第9列元素中没有非金属元素 | |
| B. | 第17列为卤族元素 | |
| C. | 只有第2列元素原子的最外层有2个电子 | |
| D. | 在整个18列元素中,第3列元素种类最多 |
分析 在长式周期表中各族元素的排列顺序为:ⅠA、ⅡA、ⅢB-→ⅦB、Ⅷ、ⅠB、ⅡB、ⅢA-→ⅦA、0族,18列元素应分别与以上各族对应.
A.第9列元素为第Ⅷ族元素;
B.第17列为卤素;
C.He以及ⅡB族元素最外层都为2电子;
D.第3列含有锕系、镧系元素.
解答 解:在长式周期表中各族元素的排列顺序为:ⅠA、ⅡA、ⅢB-→ⅦB、Ⅷ、ⅠB、ⅡB、ⅢA-→ⅦA、0族,18列元素应分别与以上各族对应.
A.第9列元素为第Ⅷ族元素,属于过度金属元素,故A正确;
B.第17列为卤素,故B正确;
C.第2列为碱土金属族,其最外层有2个电子,但元素He及多数过渡元素的最外层也是2个电子,故C错误;
D.第3列含有锕系、镧系元素,元素种类最多,故D正确.
故选C.
点评 本题考查了长式周期表中各族元素的排列顺序,明确列与族序数的排列顺序即可解答,题目难度不大,注意选项C中的特例分析.


科目:高中化学 来源: 题型:解答题
 表示的分子式为C6H14结构简式(CH3)2CHCH2CH2CH3名称是2-甲基戊烷.
表示的分子式为C6H14结构简式(CH3)2CHCH2CH2CH3名称是2-甲基戊烷.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
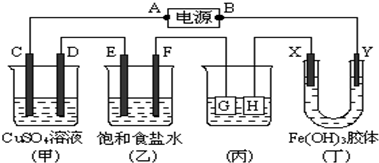
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液可能由pH=3盐酸与pH=11的NH3•H2O溶液等体积混合而成 | |
| B. | 该溶液可能由等物质的量浓度的NH3•H2O与盐酸以2:1的体积比混合 | |
| C. | 该溶液中由水电离出的氢离子浓度一定大于1.0×10-7mol•L-1 | |
| D. | 加入一定量NH3•H2O,c(NH4+)可能大于、等于或小于c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3+CO32- | |
| B. | 硫酸酸化的淀粉KI溶液在空气中变成蓝色:4I++O2+2H2O═2I2+4OH- | |
| C. | 钢铁发生吸氧腐蚀时,正极的电极反应式:O2+4e-+2H2O═4OH- | |
| D. | 氨气催化氧化生产硝酸的主要反应:4NH3+7O2$\frac{\underline{\;催化剂\;}}{高温}$4NO2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
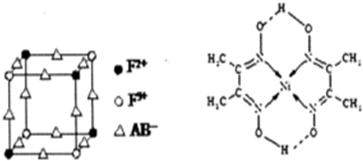
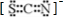 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 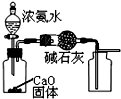 制取并收集干燥的NH3 | |
| B. | 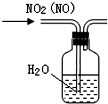 可除去NO2中的NO | |
| C. | 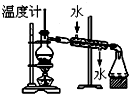 分离两种互溶但沸点相差较大的液体混合物 | |
| D. | 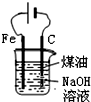 制备Fe(OH)2并能较长时间观察其颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
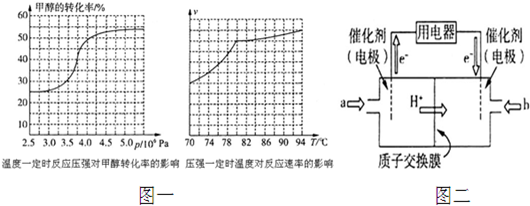
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com