
| A. | △H2>△H3 | B. | △H1>△H3 | C. | △H1+△H3=△H2 | D. | △H1+△H2<△H3 |
分析 胆矾溶于水时,溶液温度降低,该反应为吸热反应,则:CuSO4•5H2O(s)=Cu2+(aq)+SO42-(aq)+5H2O(l)△H1>0;
硫酸铜溶于水,溶液温度升高,说明该反应为放热反应,则:CuSO4(s)=Cu2+(aq)+SO42-(aq)△H2<0;
已知CuSO4•5H2O(s)=CuSO4(s)+5H2O(l)△H3,根据盖斯定律确定各焓变之间的关系,以此解答该题.
解答 解:①胆矾溶于水时,溶液温度降低,反应为CuSO4•5H2O(s)=Cu2+(aq)+SO42-(aq)+5H2O(l)△H1>0;
②硫酸铜溶于水,溶液温度升高,该反应为放热反应,则:CuSO4(s)=Cu2+(aq)+SO42-(aq)△H2<0;
③已知CuSO4•5H2O(s)=CuSO4(s)+5H2O(l)△H3;
依据盖斯定律①-②得到③:△H3=△H1-△H2,由于△H2<0,△H1>0,则△H3>0,
A.分析可知△H3>0,而△H2<0,则△H3>△H2,故A错误;
B.分析可知△H2=△H1-△H3,由于△H2<0,△H3>△H1 ,故B错误;
C..△H3=△H1-△H2,则△H1=△H3+△H2,故C错误;
D.△H2<0,△H1>0,且△H1=△H3+△H2,则△H1+△H2<△H3,故D正确.
故选D.
点评 本题考查化学反应与能量变化,为高频考点,侧重考查盖斯定律在热化学方程式计算中的应用,题目难度中等,根据盖斯定律分析物质溶解过程中的能量变化是解题关键,注意明确盖斯定律的内容及热化学方程式的书写原则.


科目:高中化学 来源: 题型:选择题
| A. | 0.15mol/L | B. | 0.3mol/L | C. | 0.225mol/L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
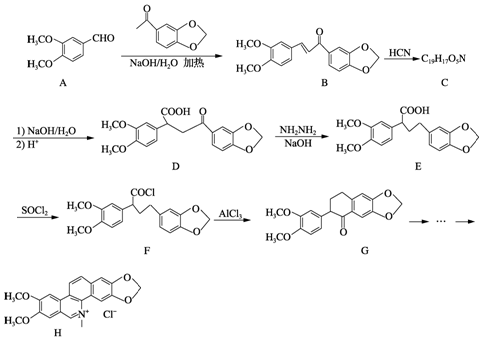
 ;由E→F的反应类型为取代.
;由E→F的反应类型为取代. .
. ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +CH3Cl$\stackrel{AlCl_{3}}{→}$
+CH3Cl$\stackrel{AlCl_{3}}{→}$ +HCl
+HCl .
. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、R为原子序数依次增大的六种元素,位于元素周期表的前四周期.B元素原子含有3个能级,且每个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子.请回答下列问题:
A、B、C、D、E、R为原子序数依次增大的六种元素,位于元素周期表的前四周期.B元素原子含有3个能级,且每个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子.请回答下列问题: ,F基态原子的外围电子排布式3d104s1.
,F基态原子的外围电子排布式3d104s1.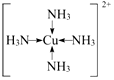 (用元素符号表示).
(用元素符号表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  可用于吸收NH3或HCl,并防止倒吸 | |
| B. | 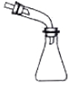 蒸馏时的接收装置 | |
| C. |  除去SO2中的少量HCl | |
| D. |  准确量取一定体积K2Cr2O7标准溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温常压下,某生物燃料电池(BFC)以乙醇为燃料,直接或间接利用酶作催化剂,其总反应为C2H5OH+3O2?2CO2+3H2O,其工作原理如图所示.下列有关说法正确的是( )
常温常压下,某生物燃料电池(BFC)以乙醇为燃料,直接或间接利用酶作催化剂,其总反应为C2H5OH+3O2?2CO2+3H2O,其工作原理如图所示.下列有关说法正确的是( )| A. | 乙醇发生还原反应 | |
| B. | b极上的电极反应式为O2+4e-+H2O--4OH- | |
| C. | 电池工作时,电解液中的H+由a极向b极迁移 | |
| D. | 当外电路中有1.2 mol电子转移时,能产生4.48 L CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,向盛有50mL pH=3的HA溶液的绝热容器中加入pH=14的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述正确的是( )
25℃时,向盛有50mL pH=3的HA溶液的绝热容器中加入pH=14的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述正确的是( )| A. | HA溶液的物质的量浓度为0.0l mol/L | |
| B. | a→b的过程中,混合溶液不可能存在:c(A-)=c(Na+) | |
| C. | b→c的过程中,温度降低的主要原因是溶液中A-发生了水解反应 | |
| D. | 25℃时,HA的电离平衡常数K约为1.25×10-6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com