
氯化铁是常见的水处理剂,无水FeCl3的熔点为555 K、沸点为588 K。
工业上制备无水FeCl3的一种工艺如下:

 (1)取0.5 mL三氯化铁溶液滴入50 mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为_________________________________________________。
(1)取0.5 mL三氯化铁溶液滴入50 mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为_________________________________________________。
(2)已知六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度 (g/100 g H2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是_______________________。
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+ 开始沉淀;当溶液pH为4时,c(Fe3+)=__________mol·L-1 ( 已知:Ksp[Fe(OH)3]=1.1×10- 36 ) 。
36 ) 。
(4)吸收剂X是______________________;吸收塔中吸收剂X的作用是_________________________________________。
(5)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100 mL容量瓶中,用蒸馏水定容; 取出10.00 mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用c mol·L-1 Na2S2O3溶液滴定(I2+2
 2I-+
2I-+ ),共用去V mL。则样品中氯化铁的质量分数为 __________________________。
),共用去V mL。则样品中氯化铁的质量分数为 __________________________。
.(1) Fe3++3H2O Fe(OH)3 (胶体)+3H+
Fe(OH)3 (胶体)+3H+
(2) 加入少量盐酸,加热浓缩,再冷却结晶
(3) 1.1×10-6 (4) FeCl2溶液, 吸收反应炉中过量的氯气和少量氯化铁烟气
(5)  %
%
【解析】本题考查了工业上制备无水FeCl3过程中的问题,碘量法测定FeCl3的质量分数。取0.5 mL三氯化铁溶液滴入50 mL沸水中,再煮沸片刻得红褐色透明液体是氢氧化铁胶体,故该过程可用离子方程式表示为Fe3++3H2O Fe(OH)3 (胶体)+3H+。
Fe(OH)3 (胶体)+3H+。
(2) 由表中数据可知,温度越高氯化铁的溶解度越高,由溶液获得晶体需加热蒸发、冷却晶体,Fe3+易水解应先加入少量的盐酸, 抑制Fe3+水解,再加热蒸发、冷却晶体获得FeCl3•6H2O。
抑制Fe3+水解,再加热蒸发、冷却晶体获得FeCl3•6H2O。
(3) 当溶液pH为4时,溶液中c(OH-)=10-10mol/L,由于Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=1.1×10-36,所以溶液中c(Fe3+)=  =1.1×10-6mol/L。
=1.1×10-6mol/L。
(4) 尾气中含有氯气,由工艺流程可知,用吸水剂X在吸收塔中吸收氯气,生成氯化铁,所以吸水剂X为氯化亚铁,也可吸收少量氯化铁烟气。
(5) VmLNa2S2O3溶液含有Na2S2O3物质的量为V×10-3 L×cmol/L=c×V×10-3 mol,则:根据关系式:

所以 n(Fe3+)=c•V•10-3 mol×10=0.01cVmol,所以m克无水氯化铁样品中氯化铁的质量为0.01cVmol×162.5g/mol=1.625cVg,所以m克无水氯化铁样品中氯化铁的质量分数为  ×100%=
×100%=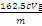 %。
%。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案科目:高中化学 来源: 题型:
某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有__________________。
(2)硫酸铜溶液可以加快氢气生成速率的原因是____________。
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________。
(4)要加快上述实验中气体产生的速率,还可采取的措施有________________________________________________________(答两种)。
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
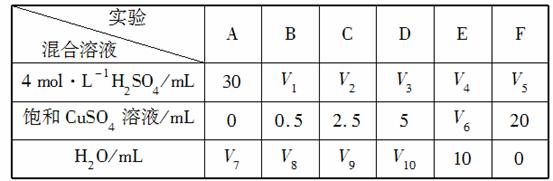
①请完成此实验设计,其中:V1=________,V6=________,V9=________;
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:
___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应PCl3g)+Cl2(g)  PCl5(g) 达到平衡时,PCl5为0.4mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5(g) 达到平衡时,PCl5为0.4mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A.0.40mol B.0.20mol C. 大于0.20mol,小于0.40mol D. 小于0.20mol
查看答案和解析>>
科目:高中化学 来源: 题型:
 中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是__________________,烧杯间填满碎塑料泡沫的作用是________________________________。
(2) 大烧杯上如不盖硬纸板,则求得的中和热数值_________(填“偏大”、“偏小’、“无影响”) (3) 实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热的数值________(填“相等”或“不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于复分解反应:X+Y→Z+W,下列叙述正确的是
A.若Z是强酸,则X和Y必有一种是强酸
B.若X是强酸,Y是盐,反应后可能有强酸或弱酸生成
C.若Y是强碱,X是盐,则Z或W必有一种是弱碱
D.若W是弱碱,Z是盐,则X和Y必有一种是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示物质结构的化学用语或模型中,正确的是
A.过氧化钠的电子式: B. S2-离子的结构示意图:
B. S2-离子的结构示意图:
C. 8个中子的碳原子的核素符号: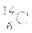 D. CH4分子的球棍模型:
D. CH4分子的球棍模型:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是( )
A.天然气和沼气的主要成分是甲烷
B.等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等
C.纤维素、油脂和蛋白质在一定条件下都能水解
D.葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
将溴水分别与酒精、己烯、己烷和四氯化碳四种试剂混合,充分振荡后静置,下列现象与所加试剂不相吻合的是( )
| A | B | C | D | |
| 与溴水混合的试剂 | 酒精 | 己烯 | 己烷 | 四氯化碳 |
| 现象 |
|
|
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com