
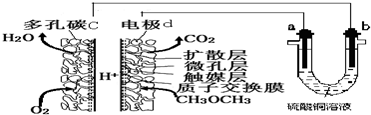
| A. | 多孔碳c能增大气固接触面积,提高反应速率,该电极为负极 | |
| B. | 燃料电池工作时,电极d上发生的反应为:CH3OCH3+12e-+3H2O═2CO2+12H+ | |
| C. | 二甲醚直接燃料电池能量密度( kW•h•kg-1)约为甲醇CH3OH)直接燃料电池能量密度的1.4倍 | |
| D. | a极是纯铜,b极是粗铜时,a极上有铜析出,b极逐渐溶解,两极质量变化相同 |
分析 A.采用多孔导电材料,可以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触,而该极是氧气放电,所以是正极;
B.电极d是负极发生氧化反应,电极反应式为CH3OCH3-12e-+3H2O═2CO2+12H+;
C.二甲醚提供1mol电子所需质量为$\frac{46}{12}$g,而甲醇(CH3OH燃烧生成二氧化碳,化合价升高6价)提供1mol电子所需质量为$\frac{30}{6}$g,依据能量密度=电池输出电能/燃料质量计算;
D.a与原电池的正极相连为电解池的阳极,铜失电子发生氧化反应,b与原电池的负极相连为电解池的阴极,铜离子得电子发生还原反应.
解答 解:A.采用多孔导电材料,可以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触,而该极是氧气放电,所以是正极,而不是负极,故A错误;
B.电极d是负极发生氧化反应,电极反应式为:CH3OCH3-12e-+3H2O═2CO2+12H+,故B错误;
C.二甲醚提供1mol电子所需质量为$\frac{46}{12}$g,而甲醇(CH3OH燃烧生成二氧化碳,化合价升高6价)提供1mol电子所需质量为$\frac{30}{6}$g,所以二甲醚直接燃料电池能量密度( kW•h•kg-1)约为甲醇(CH3OH)直接燃料电池能量密度为$\frac{30}{6}$:$\frac{46}{12}$,约为1.4倍,故C正确;
D.a与原电池的正极相连为电解池的阳极,铜失电子发生氧化反应,则纯铜溶解,b与原电池的负极相连为电解池的阴极,铜离子在粗铜上得电子发生还原反应产生铜,两极质量变化相同,故D错误;
故选C.
点评 本题考查了燃料电池和电解池的工作原理,明确正负极、阴阳极上发生的反应是解本题关键,难点是电极反应式的书写,要结合电解质溶液的酸碱性书写,注意能量密度=电池输出电能/燃料质量,题目难度不大.


科目:高中化学 来源: 题型:多选题

| A. | 羟氨苄青霉素在空气中不能很稳定地存在 | |
| B. | 每个羟氨苄青霉素分子中含有3个手性碳原子 | |
| C. | 羟氨苄青霉素既能与盐酸反应,又能与碳酸氢钠溶液反应 | |
| D. | 羟氨苄青霉素可以与FeCl3发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
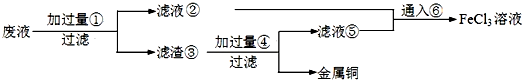
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 操作 | |
| A | 观察钠与水反应的现象 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 检验NaHCO3与Na2CO3溶液 | 用小试管分别取少量溶液,然后滴加澄清石灰水 |
| C | 证明Na2O2与CO2是放热反应 | Na2O2用棉花包裹,放入充满CO2的集气瓶中,棉花燃烧说明是放热反应 |
| D | 检验Na2CO3与K2CO3溶液 | 用稀硫酸清洗过的铂丝分别蘸取溶液,在酒精灯外焰上灼烧,透过蓝色钴玻璃观察火焰的颜色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:8 | B. | 2:5 | C. | 5:2 | D. | 5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol CH3CH2CH2CH3分子储存的能量大于1 mol (CH3)2CHCH3分子 | |
| B. | 1 mol CH3CH2CH2CH3分子储存的能量小于1 mol (CH3)2CHCH3分子 | |
| C. | (CH3)2CHCH3转化为CH3CH2CH2CH3的过程是一个放热过程 | |
| D. | 断开1 mol物质中化学键吸收的能量CH3CH2CH2CH3大于(CH3)2CHCH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com