
【题目】有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如图实验,从实验可以判断:( )

A.该固体粉末中一定不含有BaCl2
B.该固体粉末中一定含有KNO3
C.它的组成可能是CaCO3、BaCl2、Na2SO4
D.它的组成一定是CaCO3、Na2SO4、KNO3
【答案】B
【解析】
固体粉末CaCO3、Na2SO4、KNO3、BaCl2、CuSO4溶于水有沉淀、得到无色溶液,则能排除CuSO4,因为CuSO4溶于水显蓝色;难溶物溶于稀盐酸,说明一定含有碳酸钙,硫酸钠和氯化钡不会同时存在,还有一种物质就是硝酸钾。
A. 由以上分析可知,一定含有CaCO3、KNO3,硫酸钠和氯化钡不会同时存在,则组成可能为CaCO3、Na2SO4、KNO3或CaCO3、KNO3、BaCl2,故A错误;
B. 由以上分析可知,一定含有CaCO3、KNO3,硫酸钠和氯化钡不会同时存在,则组成可能为CaCO3、Na2SO4、KNO3或CaCO3、KNO3、BaCl2,故B正确;
C. 由以上分析可知,一定含有CaCO3、KNO3,硫酸钠和氯化钡不会同时存在,则组成可能为CaCO3、Na2SO4、KNO3或CaCO3、KNO3、BaCl2,故C错误;
D. 由以上分析可知,一定含有CaCO3、KNO3,硫酸钠和氯化钡不会同时存在,则组成可能为CaCO3、Na2SO4、KNO3或CaCO3、KNO3、BaCl2,故D错误;
故选B。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】利用下列实验装置进行相应的实验,不能达到实验目的的是

A. 利用图甲装置,可快速制取氨气
B. 利用图乙装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液
C. 利用图丙装置,可制取乙烯并验证其易被酸性KMnO4溶液氧化
D. 利用图丁装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列有关叙述正确的是
A.16g由O2和O3组成的混合气体中的氧原子数为2NA
B.1molN2与足量H2充分反应生成NH3的分子数为2NA
C.1mol Fe溶于过量稀硝酸,转移的电子数为3NA
D.标准状况下,2.24L苯中含有的原子数为1.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】拆开1 mol 共价键所吸收的能量或形成1 mol 共价键所释放的能量称为键能。已知:H-H键能为436 kJ /mol,H-N键能为391 kJ /mol, N2 (g)+ 3H2(g) ![]() 2NH3(g) △H=-92.4 kJ /mol,下列说法中正确的是( )
2NH3(g) △H=-92.4 kJ /mol,下列说法中正确的是( )
A. H-H比N≡N更牢固
B. N≡N键能约为946 kJ/mol
C. 合成氨反应选择适当的催化剂是为了提高H2的转化率
D. 0.5 mol N2和1.5 mol H2在题给条件下充分反应,放出热量为46.2 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下2 L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示。
X | Y | W | |
n(起始状态)/mol | 2 | 1 | 0 |
n(平衡状态)/mol | 1 | 0.5 | 1.5 |
下列说法正确的是( )
A. 升高温度,若W的体积分数减小,则此反应ΔH>0
B. 该温度下,此反应的平衡常数K=6.75
C. 增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D. 该温度下,再向该容器中加入1.5 mol W,达到新平衡时,c(X)=0.25 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将 1 mol 的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为CuSO4·5H2O(s)![]() CuSO4(s)+5H2O(l),热效应为△H 3。则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为△H 3。则下列判断正确的是( )
A. △H2>△H3
B. △H1<△H3
C. △H1+△H3=△H2
D. △H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,32gCH4和22.4LCO2的密度之比为_______;物质的量之比为______。
(2)将20gNaOH溶于水得2L溶液,则该NaOH溶液的物质的量浓度为_________;若从中取出100mLNaOH溶液,其中含有的Na+与____molNa2CO3含有的Na+数目相同。
(3)已知标准状况下,现有四种物质:
A.49g H2SO4 B.6.02×1023个H2O C.44.8L CO和CO2混合气体 D.6g H2
其中所含分子物质的量最小的是____________(填字母);所占体积最大的是________(填字母);若C中气体重量为64g,则该混合气体中CO和CO2的体积比为__________________。
(4)标准状况下,将aLHCl完全溶于100mL水,假设该溶液的密度为ρ g·mL-1,则所得盐酸溶液中溶质的物质的量为________________,溶液的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
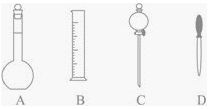
【题目】实验室配制500mL 0.2mol/L的NaOH溶液。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_____________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________、____________。
(2)填写下述过程中的空白;
具体步骤如下:
①计算需要称量NaOH固体的质量___________g;
②用托盘天平称量NaOH固体;
③将称好的NaOH固体放入烧杯中,加适量蒸馏水溶解、搅拌,并_________至室温;
④将NaOH溶液沿玻璃棒注入____________中;
⑤用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也都注入容量瓶,轻轻晃动容量瓶,使溶液混合均匀;
⑥将蒸馏水注入容量瓶,液面离刻度线下_______cm时,改用____________滴加蒸馏水至液面于刻度线相切;
⑦盖好瓶塞,反复上下颠倒,摇匀;
(3)经精确测量,最后所得溶液物质的量浓度为0.192mol/L,原因可能是_____________
A.使用滤纸称量NaOH固体;
B.溶解NaOH后的烧杯未经多次洗涤;
C.容量瓶中原来有少量蒸馏水;
D.称量时所用的砝码生锈;
E.未冷却直接转移至容量瓶,立即配好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2+ +2OH- ![]() CH3COONH4 +3NH3+2Ag↓+H2O
CH3COONH4 +3NH3+2Ag↓+H2O
B. 苯酚钠溶液中通入少量CO2:CO2 +H2O+2C6H5O-→2C6H5OH+CO32-
C. 氯乙烷中滴入AgNO3溶液检验其中氯元素:Cl-+Ag+=AgCl↓
D. 乙酸滴入氢氧化铜悬浊液中:2CH3COOH+Cu(OH)2=Cu2++2CH3COO-+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com