
| A. | 金属钠着火时,立即用沙土覆盖 | |
| B. | 大量氯气泄漏时,应顺风往低处跑 | |
| C. | 不慎洒出的酒精在桌上着火时,立即用水扑灭 | |
| D. | 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
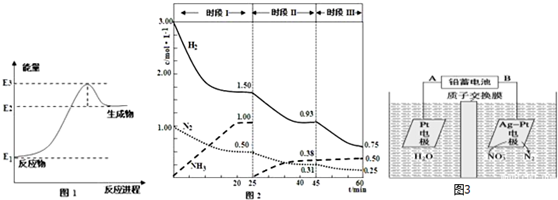
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 银白色金属 | B. | 不与氧气反应 | ||
| C. | 能发生铝热反应 | D. | 能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
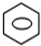 +HNO3(浓)$→_{50-60℃}^{浓H_{2}SO_{4}}$
+HNO3(浓)$→_{50-60℃}^{浓H_{2}SO_{4}}$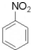 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③①②⑤ | B. | ④⑤③②① | C. | ④③②①⑤ | D. | ④②③①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com