
【题目】病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如右图所示。利用标签所提供的信息,回答下列问题:

(1)该注射液中葡萄糖的质量分数为___________
(2)葡萄糖分子的摩尔质量________________
(3)该注射液中溶质与溶剂的分子个数比为_______
(4)该注射液中溶质的物质的量浓度为________(小数点后保留2位)
(5)已知室温下,饱和葡萄糖水溶液中溶质的质量分数为51.3%, 请计算室温下葡萄糖的溶解度____________ (保留小数点后1位)。
(6)若在实验室利用葡萄糖固体配制该注射液( 500mL5%葡萄糖)在没有容量瓶的情况下,能否配制上述溶液?______,若不能说明理由,若能说明配制步骤__________________________
【答案】 5% 180 g/mol 1:190 0.28 mol/L 105.3 g 能 可用天平称25 g 葡萄糖,放入烧杯中,再用量筒量取475 mL 水,加入到烧杯中,用玻璃棒搅拌
【解析】试题分析:本题考查与溶液有关的物理量的计算,溶液的配制。
(1)根据标签,该葡萄糖注射液中葡萄糖的质量分数为5%。
(2)葡萄糖的相对分子质量为180,葡萄糖的摩尔质量为180g/mol。
(3)n(C6H12O6)=![]() =
=![]() mol;m(C6H12O6):m(H2O)=25g:m(H2O)=5%:(1-5%),m(H2O)=475g,n(H2O)=
mol;m(C6H12O6):m(H2O)=25g:m(H2O)=5%:(1-5%),m(H2O)=475g,n(H2O)=![]() =
=![]() mol,则n(C6H12O6):n(H2O)=
mol,则n(C6H12O6):n(H2O)=![]() mol:
mol:![]() mol=1:190,溶质与溶剂分子数之比为1:190。
mol=1:190,溶质与溶剂分子数之比为1:190。
(4)c(C6H12O6)=![]() mol
mol![]() 0.5L=0.28mol/L。
0.5L=0.28mol/L。
(5)设室温下葡萄糖的溶解度为S,则![]() 100%=51.3%,S=105.3g。
100%=51.3%,S=105.3g。
(6)根据(3)的计算500mL5%葡萄糖注射液中含葡萄糖25g,水的质量为475g;该题为配制质量分数的溶液,所以没有容量瓶的情况下,也能配制。配制的步骤为:用天平称25 g 葡萄糖,放入烧杯中,再用量筒量取475 mL 水,加入到烧杯中,用玻璃棒搅拌。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应H2S+O2![]() H2O2+S。已知甲池中发生的反应为:
H2O2+S。已知甲池中发生的反应为:

下列说法正确的是
A.该装置中电能转化为光能
B.H+从甲池移向乙池
C.甲池中碳棒上发生的电极反应为:AQ+2H+2e![]() H2AQ
H2AQ
D.乙池溶液中发生的反应为H2S+![]()
![]() 3I+S+2H+
3I+S+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验必须操作规范。下列说法不正确的是
A. 分液漏斗使用前必须要检查是否漏液
B. 蒸发溶液时,要用玻璃棒搅拌溶液
C. 熄灭酒精灯要用灯帽盖灭
D. 浓碱液滴在皮肤上,立即用大量水冲洗,然后涂上醋酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,120℃时通入amolCxH4(烃)和bmol O2点燃后,生成二氧化碳和水蒸气。待反应完成后,恢复至原来温度和压强,则反应前后气体体积之比为( )
A.(a+b)∶(2a+b)B.(a+b)∶(a+2b)C.1∶1D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生产生活中用途广泛。利用FeSO4制备还原铁粉的工业流程如下:

实验室中可用FeSO4(用铁粉和稀硫酸反应制得)和NH4HCO3在如下装置模拟上述流程中的“转化”环节。
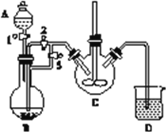
(1)装置A的名称是________,装置B中盛放的试剂是________,NH4HCO3盛放在装置________中。
(2)实验过程中,欲将生成的FeSO4溶液和NH4HCO3溶液混合制FeCO3沉淀,操作方法是________________,发生主要反应的离子方程式为_____________________。FeSO4溶液要现用现配制的原因是____________,检验久置的FeSO4是否变质的方法是______________。
(3)干燥过程主要目的是脱去游离水,过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为____________________________,取干燥后的FeCO3样品12.49 g,与碳混合后焙烧,最终得到还原铁粉6.16 g,计算样品中杂质FeOOH的质量:________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器b中可选择的试剂为________。
(2)实验室中,利用装置A,还可制取的无色气体是________(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有________性,写出相应的化学方程式:____________。
(4)E装置中浓硫酸的作用是_______________。
(5)读取气体体积前,应对装置F进行的操作:___________________。
(6)实验完毕,若测得干燥管D增重 m g,装置F测得气体的体积为 n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含字母m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的相对位置如下所示,其中Z元素最外层电子数是其电子层数的2倍。请回答下列问题:
X | Y | |
Z | W |
(1)元素Z位于周期表中的位置 。
(2)实验室制取X元素的氢化物的化学方程式为 。
(3)W、Z的最高价氧化物对应的含氧酸的酸性大小顺序 (用化学式表示)。
(4)将W的单质通入含等物质的量FeBr2的溶液中,发生反应的离子方程式为 。
(5)Z和X形成的一种化合物相对分子质量在170~190之间,且Z的质量分数约为70%。该化合物的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com