
分析 (1)先根据C=$\frac{1000ρω}{M}$计算浓硫酸的浓度,再根据浓硫酸稀释前后溶质的物质的量不变计算浓硫酸的体积;根据溶质质量+溶剂质量=溶液质量来计算溶剂质量;
(2)加入稍过量的盐酸酸化了的氯化钡溶液,所得沉淀质量为2.33克,即为硫酸钡的质量,根据硫酸根离子守恒以及化学反应原理来计算;
(3)8.70g的无水Na2S2O4物质的量是0.05mol,吸水后得到10.50g Na2S2O4•nH2O,所以0.05molNa2S2O4•nH2O中水的质量是10.5g-8.7g=1.8g,据此计算;
(4)2Na2S2O4→Na2S2O3+Na2SO3+SO2↑,4H++2S2O42-→3SO2↑+S↓+2H2O,其中Na2S2O3和Na2SO3物质的量分别为x,结合质量守恒和化学方程式定量关系列式计算,另一份Na2S2O4部分分解得到的产物B,则ag产物能是未分解,也可能是全部分解,据此计算;
解答 解:(1)质量分数为98%、密度为1.84g•cm-3的浓硫酸物质的量浓度为$\frac{1000×1.84×98%}{98}$=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=1mol•L-1×0.5L,V=0.0272L=27.2mL,500mL1mol•L(密度为1.06g•cm-3)的稀硫酸中溶质质量+溶剂质量=溶液质量,设加水的质量是m,则0.5L×1mol•L×98g/mol+m=500mL×1.06g•cm-3,解得m=481g,故答案为:27.2;481.
(2)加入稍过量的盐酸酸化了的氯化钡溶液,所得沉淀质量为2.33g即0.01mol,即为硫酸钡的量,所以被氧化的亚硫酸钠是0.01mol,被氧化亚硫酸钠的质量分数=$\frac{0.01mol×126g/mol}{10.16g}$×100%=12.6%,故答案为:12.6%;
(3)8.70g的无水Na2S2O4,物质的量是0.05mol,吸水后得到10.50g Na2S2O4•nH2O,则水合物中n的值是$\frac{10.50g-8.70g}{18g/mol}$×$\frac{1}{0.05}$=2,故答案为:2;
(4)将9.16g产物A中加入足量的稀硫酸中,生成SO21.568L(标准状况)物质的量n=$\frac{1.568L}{22.4L/mol}$=0.07mol,2Na2S2O4→Na2S2O3+Na2SO3+SO2↑,4H++2S2O42-→3SO2↑+S↓+2H2O,其中Na2S2O3和Na2SO3物质的量分别为x,未分解的Na2S2O4 物质的量为y,
2Na2S2O4→Na2S2O3+Na2SO3+SO2↑
2 1 1
2x x x
4H++2S2O42-→3SO2↑+S↓+2H2O
2 3
y 1.5y
Na2S2O3+H2SO4=Na2SO4+S+SO2+H2O
1 1
x x
Na2SO3+H2SO4=Na2SO4+SO2+H2O
1 1
x x
1.5y+2x=0.07
158x+126x+174y=9.16
x=0.02mol
y=0.02mol
则残留物0.02molNa2S2O4、0.02molNa2S2O3、0.02molNa2SO3中钠、硫和氧的原子个数比=6:5:10,
另一份Na2S2O4部分分解得到的产物B,则ag产物则ag产物能是未分解,也可能是全部分解,未分解则为Na2S2O4、B中钠、硫和氧的原子个数比为1:1:2,如全部分解为等物质的量的Na2S2O3和Na2SO3,钠、硫和氧的原子个数比为4:3:6,
故答案为:6:5:10; 4:3:6到1:1:2之间;
点评 本题考查了溶液配制和浓度计算、氧化还原反应定量计算、化学方程式计算等知识点,掌握基础是解题关键,题目难度较大.


科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C2H6 | C2H4 | C2H4O2 | C3H8 | C3H6 | C3H6O2 | C4H10 | C4H8 | C4H8O2 | C5H12 |
| A. | C9H18 | B. | C9H118O2 | C. | C8H18 | D. | C8H16O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的核电荷数依次增多 | B. | 原子核外电子层数依次增多 | ||
| C. | 原子核外次外层电子数依次增多 | D. | 原子量依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
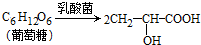
| 次数 | 1 | 2 | 3 | 4 |
| 滴定体积(mL) | 19.22 | 19.18 | 19.80 | 19.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
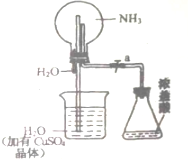 如图,室温下,挤压胶头滴管.待现象发生时,再打开活塞a,烧瓶中能观察到的现象是先形成蓝色喷泉,然后有蓝色沉淀生成后溶解变为蓝色溶液,有关的化学方程式是NH3+H2O=NH3.H2O、CuSO4+2NH3.H2O=Cu(OH)2↓+(NH4)2SO4、Cu(OH)2+2HCl=CuCl2+H2O.
如图,室温下,挤压胶头滴管.待现象发生时,再打开活塞a,烧瓶中能观察到的现象是先形成蓝色喷泉,然后有蓝色沉淀生成后溶解变为蓝色溶液,有关的化学方程式是NH3+H2O=NH3.H2O、CuSO4+2NH3.H2O=Cu(OH)2↓+(NH4)2SO4、Cu(OH)2+2HCl=CuCl2+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
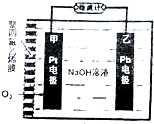 氧电化学传感器可用于测定O2含量,下图为某种氧电化学传感器的原理示意图,已知在测定O2含量过程中,电解质溶液的质量保持不变,一段时间内,若通过传感器的待测气体为aL(标准状况),某电极增重了bg.下列说法正确的是( )
氧电化学传感器可用于测定O2含量,下图为某种氧电化学传感器的原理示意图,已知在测定O2含量过程中,电解质溶液的质量保持不变,一段时间内,若通过传感器的待测气体为aL(标准状况),某电极增重了bg.下列说法正确的是( )| A. | Pt电极上发生氧化反应 | |
| B. | Pt上发生的电极反应式为4OH--4e-═O2↑+2H2O | |
| C. | 反应过程中转移OH-的物质的量为0.25bmol | |
| D. | 待测气体中氧气的体积分数为0.7$\frac{b}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇不能发生取代反应 | B. | C4H10(丁烷)有三种同分异构体 | ||
| C. | 氨基酸、淀粉均属于高分子化合物 | D. | 油脂和蛋白质均可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(用所对应的元素符号表示):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com