
在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:填空题
(18分)已知可逆反应CO2(g) + H2(g) CO(g) + H2O(g),
CO(g) + H2O(g),
⑴写出该反应的化学平衡常数表达式:K= 。
⑵830K时,若起始时:c (CO2)=2mol/L,c (H2)=3mol/L,平衡时CO2的转化率为60%,氢气的转化率为 ;K值为 。
⑶830K时,若只将起始时c (H2)改为6mol/L,则氢气的转化率为 。
⑷若830K时,起始浓度c (CO2) =" a" mol/L,c (H2) =" b" mol/L,H2O的平衡浓度为c (H2O) =" c" mol/L,则:①a、b、c之间的关系式是 ;②当a = b时,a = c。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g)(正反应为放热反应)。现将一定
N2O4(g)(正反应为放热反应)。现将一定
量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示,回答下列问题:
(1)图中共有两条曲线X和Y,其中曲线________表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是________。
(2)前10 min内用NO2表示的化学反应速率v(NO2)=________mol/(L·min);反应进行至25 min时,曲线发生变化的原因是________。
(3)若要达到与最后相同的化学平衡状态,在25 min时还可以采取的措施是________。
| A.加入催化剂 | B.缩小容器体积 |
| C.升高温度 | D.加入一定量的N2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
可逆反应A(?)+aB(g)  C(g)+D(g),其中a为正整数。反应过程中,当其他条件不
C(g)+D(g),其中a为正整数。反应过程中,当其他条件不
变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。试回答下列问题: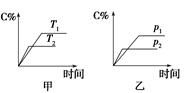
(1)化学方程式中a= ,反应物A的状态是 。
(2)该反应的焓变值ΔH (填“>”或“<”)0,在不改变其他条件的情况下增加B的物质的量,平衡 (填“正”或“逆”)向移动,平衡常数K (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
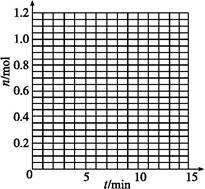
某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据表中数据,在图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
298 K时,某容积固定为1 L的密闭容器中发生如下可逆反应:A(g) 2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。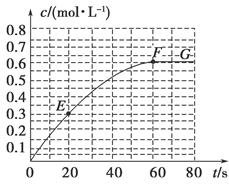
试回答下列问题。
(1)已知298 K时60 s达到平衡,比较40~60 s内和60~80s内B的平均反应速率:v(40~60) v(60~80)(填“﹥”或“﹦”或“﹤”)。
(2)若298 K达到平衡时,B的平衡浓度为A的3倍,共放出热量x kJ,开始加入A的物质的量是 mol。
(3)298k时,该反应的平衡常数为 mol/L。
(4)若反应在298 K进行,在1 L密闭容器中加入1 mol B、0.2 mol Ne,达到平衡时共吸收热量y kJ,此时B的转化率为 (填序号)。
A.等于60% B.等于40%
C.小于40% D.介于40%~60%之间
(5)结合(2)、(4)相关数据,写出a、x、y三者的等式关系式: 。
(6)若反应在298K进行,反应起始浓度为c(A)=c(B)=1.0mol/L,则化学平衡将 (填“正向”“逆向”或“不”)移动。
(7)已知曲线上任意两点之间连线的斜率表示该时间段内B的平均反应速率(例如直线EF的斜率表示20 s~60 s内B的平均反应速率),则曲线上任意一点的切线斜率的意义是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)(△H<0)
(1)写出该反应的化学平衡常数表达式K=
(2)降低温度,该反应K值 ,二氧化硫转化率 ,化学反应速率 (以上均填增大、减小或不变)。
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。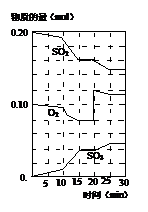
(4)据图判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达)。
(5)10min到15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量。
(6)能说明该反应已经达到平衡状态的是( )
a. v(SO3)=2v(O2) b.容器内压强保持不变
c.v逆(SO2)=2v正(O2) d.恒容容器内物质的密度保持不变
(7)为使该反应的反应速率增大,且平衡向正反应方向移动的是( )
a.及时分离出SO3气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
已知COCl2(g)  Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):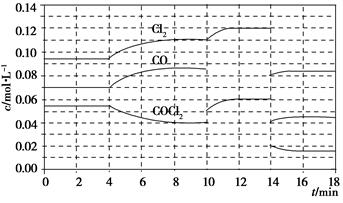
(1)化学平衡常数表达式K=________,计算反应在第8 min时的平衡常数K=________;
(2)比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)________T(8)(填“<”、“>”或“=”);
(3)若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=________;10~12 min内CO的平均反应速率为v(CO)=________;
(4)比较产物CO在2~3min、5~6min和12~13min时平均反应速率(平均反应速率分别以v(2~3)、v(5~6)、v(12~13))的大小________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g) TaI4(g)+S2(g) ΔH>0(I)
TaI4(g)+S2(g) ΔH>0(I)
反应(Ⅰ)的平衡常数表达式K=________,若K=1,向某恒容容器中加入1 mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为________。
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1________T2(填“>”“<”或“=”)。上述反应体系中循环使用的物质是________。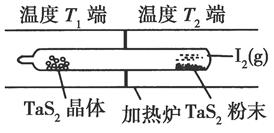
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为________,滴定反应的离子方程式为______________________。
(4)25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中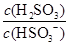 将________(填“增大”“减小”或“不变”)。
将________(填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com