
| A. | 破坏臭氧层--氮氧化物 | |
| B. | 酸雨--二氧化碳 | |
| C. | 水体富营养化--含N,P 元素多的废水 | |
| D. | 光化学烟雾--二氧化氮 |
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:选择题
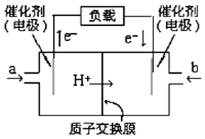 如图是甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列说法不正确的是( )
如图是甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列说法不正确的是( )| A. | 左边的电极为电池的负极,a处通入的是甲醇 | |
| B. | 每消耗3.2 g氧气转移的电子为0.4 mol | |
| C. | 电池负极的反应式为:CH3OH+H2O-6e-═CO2+6H+ | |
| D. | 电池的正极反应式为:O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强碱性溶液中:K+,Mg2+,SO42- | |
| B. | pH=1的硝酸溶液中:Fe3+,Na+,Cl- | |
| C. | pH=1的盐酸溶液中:AlO2-,Na+,SO42- | |
| D. | 某无色溶液中:Al3+,K+,OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硅(Si)、镓(Ga)和硒(Se)的化合物是制造太阳能电池的重要材料.
硅(Si)、镓(Ga)和硒(Se)的化合物是制造太阳能电池的重要材料.| SiF4 | SiCl4 | SiBr4 | SiI4 | |
| 沸点(K) | 177.4 | 330.1 | 408 | 460.6 |
| Si-X键键长(pm) | 154 | 201 | 215 | 234 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
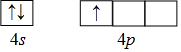
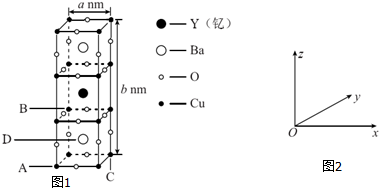
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2是直线型分子,推测CS2也是直线型分子 | |
| B. | SiH4的沸点高于CH4,推测HCl的沸点高于HF | |
| C. | Fe与Br2反应生成FeBr3,推测Fe与I2反应生成FeI3 | |
| D. | NaCl与浓H2SO4加热可制HCl,推测NaI与浓H2SO4加热可制HI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将混合气中的氨气液化分离,有利于合成氨的反应 | |
| B. | 用过量氮气与氢气反应可以提高氢气的转化率 | |
| C. | 密闭容器中发生反应H2(g)+I2(g)?2HI(g),增大压强时容器中颜色加深 | |
| D. | 加压有利于SO2与O2反应生成SO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com