
| ||
| ||


科目:高中化学 来源: 题型:阅读理解
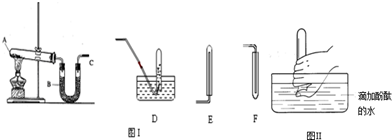
 为测定Na3CO3与Na2SO3混合物中各组分的含量,取样品23.2g,用下图所示装置进行实验(铁架台、铁夹等仪器未在图中画出):
为测定Na3CO3与Na2SO3混合物中各组分的含量,取样品23.2g,用下图所示装置进行实验(铁架台、铁夹等仪器未在图中画出):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为测定Na3CO3与Na2SO3混合物中各组分的含量,取样品23.2g,用下图所示装置进行实验(铁架台、铁夹等仪器未在图中画出):
为测定Na3CO3与Na2SO3混合物中各组分的含量,取样品23.2g,用下图所示装置进行实验(铁架台、铁夹等仪器未在图中画出):查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源: 题型:
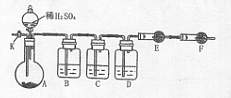
 (08上海松江区模拟)乙酸乙酯是重要的工业原料和溶剂。现利用如图
(08上海松江区模拟)乙酸乙酯是重要的工业原料和溶剂。现利用如图
装置制取乙酸乙酯粗产品,再测定乙酸乙酯的含量。
⑴写出此反应的化学方程式
;
该反应要在浓硫酸存在的条件下进行,浓硫酸的作用是
;
⑵实验室一般用饱和碳酸钠溶液接收反应的生成物。若不
振荡该试管,可看到的现象是 ,若振
荡该试管,可看到的现象是 ,但有时却出现了白色晶体,该晶体是 ;
 ⑶对于制乙酸乙酯的上述装置,为了提高产率,请提出
⑶对于制乙酸乙酯的上述装置,为了提高产率,请提出
一条改进意见:
。
⑷为测定乙酸乙酯的含量,进行了如下操作:
(I)准确称量20.0g乙酸乙酯粗品于锥形瓶中,用0.50mol/L
NaOH滴定(酚酞做指示剂)。终点时消耗NaOH溶液的体积为
40.0mL;
(II)另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL
2.1mol/LNaOH溶液混合均匀后,装上冷凝管,在水浴上加热回
流约1小时,装置如图所示。待冷却后,用0.50mol/LHCl滴定
过量的NaOH。终点时消耗盐酸的体积为20.0mL。
回答:
①实验(I)中达到滴定终点时的现象是 。
②实验(II)中冷水从冷水凝管的 (填a或b)管口通入。
③利用实验(I)、(II)测量的数据计算粗产物中乙酸乙酯的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年重庆市沙坪坝区南开中学高三(上)月考化学试卷(12月份)(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com