
| A. | Na2CO3 KCl | B. | NaCl KCl | C. | CaCl2 NaCl | D. | K2CO3 CaCl2 |
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
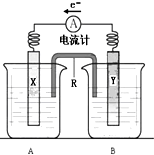 如图是铜锌原电池装置.其电池的总反应是:
如图是铜锌原电池装置.其电池的总反应是:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,活化分子百分数增大,有效碰撞的几率增大,反应速率增大 | |
| B. | 增大反应物浓度,单位体积内活化分子数增多,有效碰撞的几率增大,反应速率增大 | |
| C. | 具有足够能量的分子相互碰撞就一定能发生化学反应 | |
| D. | 正催化剂能降低反应的活化能,提高活化分子百分数,有效碰撞的几率增大,反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:S<S2-<K | B. | 稳定性:H2O>H2S>PH3 | ||
| C. | 酸性:H3PO4<HNO3<HClO4 | D. | 沸点:HF<HCl<HBr<HI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
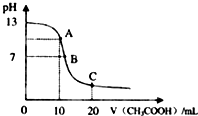 某学生在实验室测定一未知浓度的稀盐酸,已知25℃时,在20ml氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示:
某学生在实验室测定一未知浓度的稀盐酸,已知25℃时,在20ml氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示:| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积 | 19.00 | 21.81 | 21.79 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向生成I2的方向移动 | B. | HI分子减少 | ||
| C. | I2的分子数增多 | D. | I2的浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
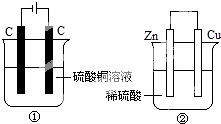 如图两个装置中,分别装有200mL对应的饱和溶液,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,分别装有200mL对应的饱和溶液,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | ②中负极:2H++2e-═H2↑ | |
| D. | 溶液的pH变化:①减小,②增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com