

分析 (1)该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,根据转移电子守恒、原子守恒配平方程式;
(2)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要和不需要的仪器;
(3)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(4)根据2KMnO4+5H2C2O4+3H2SO4═1K2SO4+10CO2↑+2MnSO4+8H2O,利用关系式法计算:5CaC2O4~5H2C2O4~2KMnO4,原溶液中Ca2+的质量浓度计算公式为c=$\frac{m}{V}$,注意浓度的单位为g•L-1;
(5)由图可知:A处CaC2O4的质量为6.4 g,B为5 g.观察化学式:CaC2O4,其逐步分解的固体产物必为含Ca的化合物,则产物B的物质的量应与CaC2O4相同,设B的相对分子质量分别为x,根据关系式计算B的相对分子质量,据此判断B的化学式,进而书写固体A到B的化学方程式.
解答 解:(1)该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,其转移电子总数为10,根据转移电子守恒知,KMnO4的计量数是2、H2C2O4的计量数是5,再根据原子守恒得方程式为2KMnO4+5H2C2O4+3H2SO4═1K2SO4+10CO2↑+2MnSO4+8H2O,
故答案为:2;5;3;1;2;10;8;
(2)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知,配制0.1000mol•L-1的KMnO4标准溶液需要的仪器有:量筒、烧杯、玻璃棒、容量瓶、胶头滴管,故不需要的仪器是A(圆底烧瓶)C(分液漏斗),还需要的仪器有:烧杯、玻璃棒,
故答案为:AC;烧杯、玻璃棒;
(3)若定容时仰视刻度线,导致溶液的体积偏大,所以配制溶液的浓度偏低,故所得溶液浓度小于0.1000mol•L-1,若KMnO4标准溶液在转移至容量瓶时,洒落了少许,则会成溶质的损失,使所配溶液的浓度偏低,故所得溶液浓度小于0.1000mol•L-1,
故答案为:<;<;
(4)根据2KMnO4+5H2C2O4+3H2SO4═1K2SO4+10CO2↑+2MnSO4+8H2O,5CaC2O4~5H2C2O4~2KMnO4,则
5Ca2+~~~~2MnO4-
n(Ca2+) 0.1mol•L-1×0.02L 解得:n(Ca2+)=0.005mol,100mL该溶液Ca2+的质量浓度为c=$\frac{m}{V}$=$\frac{0.005mol×40g/mol}{0.1L}$=2g/L故答案为:2;
(5)设B的相对分子质量分别为x,则:
由CaC2O4~~~~B
128 x
6.4g 5g 所以x=$\frac{128×5g}{6.4g}$=100,CaC2O4相对分子质量为128,B与CaC2O4的相对分子质量相差28,则B为CaCO3,
所以固体A到B的化学方程式为:CaC2O4$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3+CO↑,
故答案为:CaC2O4$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3+CO↑.
点评 本题考查了氧化还原反应的配平、一定物质的量浓度溶液的配制过程中的计算和误差分析、滴定过程的计算应用、化学式的推断,为高频考点,侧重分析与实验、计算能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| B. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| C. | 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何晶体中,若含有阳离子也一定含有阴离子 | |
| B. | 在电子云示意图中,小黑点密集表示电子在核外空间单位体积内电子出现的机会多 | |
| C. | 强电解质溶液一定比弱电解质溶液的导电能力强 | |
| D. | 常用原子光谱进行有机物相对分子质量的测定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 49个 | B. | 50个 | C. | 51个 | D. | 102个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
| A. | 常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好 | |
| B. | 常温下,除去NaCl溶液中的CaCl2杂质,选用Na2CO3溶液比NaOH溶液效果好 | |
| C. | 向含有Mg2+,Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.125×1021 | |
| D. | 无法利用Ca(OH)2制备NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温结构陶瓷是新型无机非金属材料 | |
| B. | 钢是用量最大、用途最广的合金,分为碳素钢和合金钢 | |
| C. | 硅芯片是各种计算机、微电子产品的核心材料 | |
| D. | 单晶硅常用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  铁钉易被腐蚀 | |
| B. |  滴加少量KSCN溶液,溶液变为血红色 | |
| C. |  燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. | 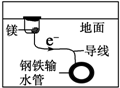 用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com