
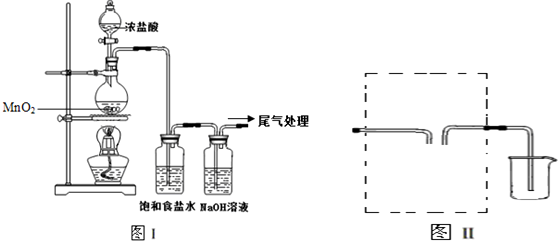
分析 (1)实验室用二氧化锰与浓盐酸反应制取氯气,反应生成氯化锰、氯气和水,HCl和MnCl2拆成离子;
(2)制取的氯气中含有挥发出来的氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度很小;
(3)氯气密度大于空气,能溶于水,但是在饱和食盐水中溶解度小,所以可以用排饱和食盐水的方法,比空气重可以利用向上排空气方法收集;
(4)①要证明NaClO氧化了Na2SO3的实验,应验证生成物中的硫酸根离子存在;
②依据酚酞遇碱溶液变红设计实验进行分析判断.
解答 解:(1)浓盐酸和二氧化锰在加热条件下发生反应生成氯气的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应的离子方程式为;MnO2+2Cl-+4H + $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+2Cl-+4H + $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)制取的氯气中含有氯化氢,饱和食盐水可以吸收氯化氢,减小氯气溶解度,故答案为:除去氯气中的氯化氢;
(3)收集氯气需要利用排饱和氯化钠溶液的方法收集,导气管短进长出或利用氯气比空气重,利用向上排空气法收集,装置图为: 或
或 ,
,
故答案为: 或
或 ;
;
(4)①要证明NaClO氧化了Na2SO3的实验,应验证生成物中的硫酸根离子存在;
a.向混合后的溶液中加入过量盐酸,无现象说明,故a不符合;
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液,生成白色沉淀证明生成硫酸钡沉淀,证明亚硫酸钠被氧化为硫酸钠,故b符合;
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液,硝酸具有氧化性可以氧化亚硫酸钠为硫酸钠也可以生成硫酸银沉淀干扰氯离子的检验,故c不符合;
d.向混合后的溶液中加入氢氧化钡溶液,生成白色沉淀,再加入过量盐酸沉淀不溶证明原溶液中生成了硫酸钠,证明亚硫酸钠被氧化,故d符合;
故答案为:bd;
②酚酞试液遇碱变红,为证明NaClO氧化了酚酞向混合后的溶液中加入NaOH溶液,若溶液不变红说明酚酞已经被氧化;若溶液变红说明酚酞没有被氧化;
故答案为:向混合后的溶液中加入NaOH溶液,若溶液不变红说明酚酞已经被氧化;若溶液变红说明酚酞没有被氧化.
点评 本题考查了氯气的实验室制备,氯气的性质验证和实验方案的设计,掌握实验基础和明确物质的性质是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
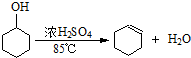
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
 、SO2、CO2及水蒸气,混合气体通过试剂的顺序是④⑤①⑤②③(或④⑤①⑤③②) (填序号)
、SO2、CO2及水蒸气,混合气体通过试剂的顺序是④⑤①⑤②③(或④⑤①⑤③②) (填序号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清的石灰水与盐酸的反应:OH-+H+═H2O | |
| B. | 氧化镁与稀硝酸反应:O2-+2H+═H2O | |
| C. | 硫酸镁溶液与氢氧化钡溶液与混合:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙溶于稀盐酸中:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2通入品红溶液中,溶液褪色 | |
| B. | 新制氯水密闭放置一段时间后浅黄绿色消失 | |
| C. | 向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 | |
| D. | 石灰水暴露在空气中变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 凡含有食品添加剂的食物对人体健康均有害,不可食用 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 | |
| D. | 酸钡难溶于水和酸,可做X光透视肠胃的药剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素、聚酯纤维、光导纤维都属于有机高分子 | |
| B. | 用卤水点豆腐与黄河入海口处沙洲的形成,都体现了胶体聚沉的性质 | |
| C. | 用活性炭为有色物质脱色和用漂白粉漂白有色物质,原理相似 | |
| D. | 为增强84消毒液的消毒效果,使用时可加入浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第3周期非金属元素含氧酸的酸性从左到右依次增强 | |
| B. | HCl、H2S、PH3的稳定性逐渐减弱 | |
| C. | 第3周期自左往右原子和离子半径均依次减小 | |
| D. | 向MgCl2溶液中加入金属钠发生2Na+MgC12═2NaC1+Mg,所以金属性Na>Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| B | C |
| D |
| A. | 简单离子的半径大小关系:C>E | |
| B. | 因C元素气态氢化物的沸点比D元素气态氢化物高,所以C原子得电子能力大于D原子 | |
| C. | 由A、B、C三种元素组成的离子化合物中,阴、阳离子个数比为1:1 | |
| D. | 由C、D、E三种元素组成的化合物,溶液显中性或碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L甲烷中含有的氢原子数为2NA | |
| B. | 分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g | |
| C. | 高温下,16.8g铁与足量的水蒸气充分反应,失去的电子数为0.8NA | |
| D. | 标准状况下,2.24L戊烷所含分子数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com