
【题目】Ⅰ.用惰性电极电解200 mL一定浓度的硫酸铜溶液,实验装置如图①所示,电解过程中的实验数据如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。

(1)下列说法正确的是______(填序号)。
A.电解过程中,b电极表面先有红色物质析出,后有气泡产生
B.a电极上发生的反应为2H++2e-==H2↑和4OH--4e-==2H2O+O2↑
C.从P点到Q点时收集到的混合气体的平均摩尔质量为12 g·mol-1
D.OP段表示H2和O2混合气体的体积变化,PQ段表示O2的体积变化
(2)如果向所得的溶液中加入0.1 mol Cu(OH)2后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为________mol。
(3)如果向所得的溶液中加入0.1 mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和pH(不考虑CO2的溶解),电解过程中转移的电子为________mol。
Ⅱ. 金属腐蚀是我们日常生活的常见现象(如图所示)。

(1)如图铜板上铁铆钉处的腐蚀属于____腐蚀。
(2)分析此腐蚀过程,下列有关说法中,不正确的是____。
A.正极电极反应式为:2H++2e-=H2↑
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe移向Cu
【答案】 C 0.4 0.6 吸氧 A
【解析】Ⅰ.(1)由图可知,电流由正极流向负极,则b为阳极,a为阴极,惰性电极电解一定量的硫酸铜溶液,发生2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,结合图②可知,通过0.2mol电子时电解硫酸铜,然后电解硫酸溶液,发生2H2O
2Cu+O2↑+2H2SO4,结合图②可知,通过0.2mol电子时电解硫酸铜,然后电解硫酸溶液,发生2H2O![]() 2H2↑+O2↑,P到Q点时收集到的混合气体为氢气和氧气,以此来解答;
2H2↑+O2↑,P到Q点时收集到的混合气体为氢气和氧气,以此来解答;
(2)根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,加入Cu(OH)2后溶液与电解前相同,则铜离子和氢氧根放电;
(3)电解硫酸铜溶液后溶液呈酸性,向电解后的溶液中加入碱式碳酸铜能恢复原溶液,碱式碳酸铜和硫酸反应生成硫酸铜、水和二氧化碳,溶液质量增加的量是铜、氢氧根离子,所以实际上电解硫酸铜溶液分两个阶段:第一阶段2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,第二阶段:2H2O
2Cu+O2↑+2H2SO4,第二阶段:2H2O![]() 2H2↑+O2↑,将碱式碳酸铜化学式改变为2CuOH2OCO2,所以加入0.1molCu2(OH)2CO3就相当于加入0.2molCuO和0.1mol水,根据氧化铜和水的量计算即可。
2H2↑+O2↑,将碱式碳酸铜化学式改变为2CuOH2OCO2,所以加入0.1molCu2(OH)2CO3就相当于加入0.2molCuO和0.1mol水,根据氧化铜和水的量计算即可。
Ⅱ.(1)根据图示可知,铜板上的铁铆钉易发生腐蚀,是由于铜和铁构成了原电池,发生了吸氧腐蚀;
(2)在此腐蚀的过程中,铁做负极失去电子,氧气在正极上得电子,电子由负极移向正极,据此分析。
Ⅰ.(1)由图可知,电流由正极流向负极,则b为阳极,a为阴极,惰性电极电解一定量的硫酸铜溶液,发生2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,结合图②可知,通过0.2mol电子时电解硫酸铜,然后电解硫酸溶液,发生2H2O
2Cu+O2↑+2H2SO4,结合图②可知,通过0.2mol电子时电解硫酸铜,然后电解硫酸溶液,发生2H2O![]() 2H2↑+O2↑则
2H2↑+O2↑则
A.b为阳极,溶液中的氢氧根离子放电,则不会有红色物质析出,A错误;
B.a为阴极,先发生Cu2++2e-=Cu,后发生2H++2e-=H2↑,B错误;
C.到Q点时收集到的混合气体为氢气和氧气,由电解水反应可知0.2mol电子通过时生成0.1molH2、0.05molO2,则混合气体的平均摩尔质量为(0.1mol×2g/mol+0.05mol×32g/mol)/(0.1mol+0.05mol)=12gmol-1,C正确;
D.由上述分析可知,曲线0~P段表示O2的体积变化,曲线P~Q段表示H2和O2混合气体的体积变化,D错误;
答案选C;
(2)Cu(OH)2从组成上可看成CuOH2O,加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH,即电解生成了0.1mol铜,并电解了0.1mol H2O,由电解的总反应式可知
2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4转移电子
2Cu+O2↑+2H2SO4转移电子
2mol 4mol
0.1mol 0.2mol
2H2O![]() 2H2↑+O2↑转移电子
2H2↑+O2↑转移电子
2mol 4mol
0.1mol 0.2mol
所以电解过程中共转移电子为0.4mol;
(3)电解硫酸铜溶液后溶液呈酸性,向电解后的溶液中加入碱式碳酸铜能恢复原溶液,碱式碳酸铜和硫酸反应生成硫酸铜、水和二氧化碳,溶液质量增加的量是铜、氢氧根离子,所以实际上电解硫酸铜溶液分两个阶段:第一阶段:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,第二阶段:2H2O
2Cu+O2↑+2H2SO4,第二阶段:2H2O![]() 2H2↑+O2↑,将碱式碳酸铜化学式改变为2CuOH2OCO2,所以加入0.1molCu2(OH)2CO3就相当于加入0.2molCuO和0.1mol水。第一阶段:根据铜原子守恒知,电解硫酸铜溶液析出n(Cu)=n(CuO)=0.2mol,转移电子的物质的量=0.2mol×2=0.4mol;第二阶段:电解生成0.1mol水转移电子的物质的量=0.1mol×2=0.2mol,
2H2↑+O2↑,将碱式碳酸铜化学式改变为2CuOH2OCO2,所以加入0.1molCu2(OH)2CO3就相当于加入0.2molCuO和0.1mol水。第一阶段:根据铜原子守恒知,电解硫酸铜溶液析出n(Cu)=n(CuO)=0.2mol,转移电子的物质的量=0.2mol×2=0.4mol;第二阶段:电解生成0.1mol水转移电子的物质的量=0.1mol×2=0.2mol,
所以电解过程中共转移的电子数为0.4mol+0.2mol=0.6mol。
Ⅱ.(1)根据图示可知,铜板上的铁铆钉易发生腐蚀,是由于铜和铁构成了原电池,发生了吸氧腐蚀;
(2)A.正极上放电的是氧气,故正极的电极反应式为O2+4e-+2H2O=4OH-,A错误;
B.在铁发生吸氧腐蚀时,铁在负极上失去电子:Fe-2e-=Fe2+,氧气在正极上放电:O2+4e-+2H2O=4OH-,故总反应为:2Fe+O2+2H2O=2Fe(OH)2,而Fe(OH)2有强还原性,易被氧气氧化,即能发生反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3,B正确;
C.此过程中铜做正极被保护,并未被腐蚀,C正确;
D.此过程中电子从负极移向正极,即由Fe移向Cu,D正确。
答案选A。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】分子式均为C5H10O2的两种有机物的结构简式如右图所示:
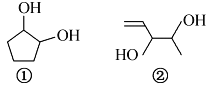
下列说法正确的是
A. 二者都能使Br2的CCl4溶液褪色
B. ①②分子中所有原子均可能处于同一平面
C. 等质量的①和②分别与足量钠反应生成等质量的H2
D. 与其互为同分异构体的酯有8种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个蛋白质分子由四条肽链组成,364个氨基酸形成,则这个蛋白质分子含有的-COOH和-NH2 数目分别为 ( )
A. 366、366 B. 362、362 C. 4、 4 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH=0的溶液中,能大量共存的离子组是( )
A. K+、Fe3+、SO42-、I- B. Na+、NO3-、SiO32-、K+
C. Mg2+、NH4+、Cl-、NO3- D. Fe2+、Na+、HSO3-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,充分燃烧一定量的丁烷放出热量Q kJ(Q>0),经测定完全吸收生成的CO2需消耗5 mol/L的KOH溶液100 mL,恰好生成正盐,则此条件下反应C4H10(g)+13/2O2(g)===4CO2(g)+5H2O(g)的ΔH为
A. +8Q kJ/mol B. +16Q kJ/mol
C. -8Q kJ/mol D. -16Q kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A+3B=2C+D在某段时间内以A的浓度变化表示的化学反应速率为2 mol·L-1·s-1,则此段时间内用B的浓度变化表示的化学反应速率为( )。
A.5 mol·L-1·s-1 B.6 mol·L-1·s-1 C.2 mol·L-1·s-1 D.3 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是 ( )
A.N2是大气中的主要成分之一,雷雨时,可直接转化为NO2
B.硝酸不稳定,受热或光照易分解
C.铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处
D.Cl2能与金属活动顺序表中大多数金属反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 都是金属,把 X 浸入 Z 的硝酸盐溶液中,X 的表面有 Z 析出,X 和 Y 组成原电池时,Y 为电池的负极。X、Y、Z 三种金属的活动性顺序为( )
A.X>Y>ZB.X>Z>YC.Y>X>ZD.Y>Z>X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com